
题目列表(包括答案和解析)

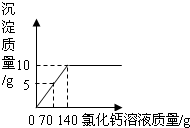 为了测定某纯碱样品中碳酸钠和氯化钠的含量(其他成分可忽略),将一定量的该样品溶解在100g水中,加入足量的氯化钙溶液,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,反应中物质间的质量关系如右图所示.当反应恰好完成时过滤,测得滤液中氯化钠的质量分数为6%.试计算该样品中:
为了测定某纯碱样品中碳酸钠和氯化钠的含量(其他成分可忽略),将一定量的该样品溶解在100g水中,加入足量的氯化钙溶液,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,反应中物质间的质量关系如右图所示.当反应恰好完成时过滤,测得滤液中氯化钠的质量分数为6%.试计算该样品中:
| 3(m1+m2) |
| 11 |
| 3(m1+m2) |
| 11 |
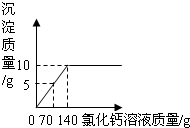 为了测定某纯碱样品中碳酸钠和氯化钠的含量(其他成分可忽略),将一定量的该样品溶解在100g水中,加入足量的氯化钙溶液,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,反应中物质间的质量关系如右图所示.当反应恰好完成时过滤,测得滤液中氯化钠的质量分数为6%.试计算该样品中:
为了测定某纯碱样品中碳酸钠和氯化钠的含量(其他成分可忽略),将一定量的该样品溶解在100g水中,加入足量的氯化钙溶液,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,反应中物质间的质量关系如右图所示.当反应恰好完成时过滤,测得滤液中氯化钠的质量分数为6%.试计算该样品中:(3分)为了测定某纯碱样品中碳酸钠和氯化钠的含量(其他成分可忽略),将一定量的该样品溶解在100g水中,加入足量的氯化钙溶液,反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,反应中物质间的质量关系如右图所示。当反应恰好完成时过滤,测得滤液中氯化钠的质量分数为6%。试计算该样品中: 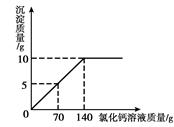
(1)氯化钠的质量;
(2)碳酸钠的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com