
题目列表(包括答案和解析)
下图为元素周期表的一部分。
| ||||||||||||||||
(1)图中阴影部分所示区域的元素称为________元素,下列元素属于该区域元素的元素符号是_______;
A.Ba B.Fe C.Br D.Rb
(2)已知A、B、C、D、E、F六种短周期元素的原子半径和某些化合价如下表所示:
| 元素 | A | B | C | D | E | F |
| 化合价 | -2 | +5、-3 | +4、-4 | +6、-2 | +2 | +1 |
| 原子半径/nm | 0.074 | 0.075 | 0.077 | 0.102 | 0.160 | 0.186 |
试将D、F两种元素的元素符号填入上图所示周期表中的相应位置。
(3)C有最高价氧化物与E的单质在一定条件下发生反应的化学方程式为:______________________________;由F的化合物生成A的单质的化学方程式为______________________________________。
(4)C与氢元素可组成一种气体,该气体在标准状况下的密度为1.25 g/L,写出实验室制取该气体的化学方程式______________________________________。
(17分)
Ⅰ.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界,并画出金属和非金属的分界线,用阴影画出铁元素所在的族。
Ⅱ. A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,画出B元素简单离子结构示意图 ,乙物质的电子式是
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
(4)简述比较D与E金属性强弱的实验方法:
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用)其反应方程式为
(17分)
Ⅰ.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界,并画出金属和非金属的分界线,用阴影画出铁元素所在的族。
Ⅱ. A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,画出B元素简单离子结构示意图 ,乙物质的电子式是
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
(4)简述比较D与E金属性强弱的实验方法:
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用)其反应方程式为
(17分)

Ⅰ.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界,并画出金属和非金属的分界线,用阴影画出铁元素所在的族。
Ⅱ. A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,画出B元素简单离子结构示意图 ,乙物质的电子式是
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
(4)简述比较D与E金属性强弱的实验方法:
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用)其反应方程式为
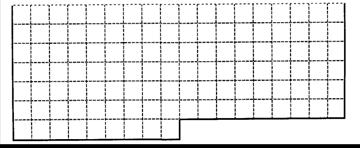
Ⅰ.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界,并画出金属和非金属的分界线,用阴影画出铁元素所在的族。
Ⅱ. A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,画出B元素简单离子结构示意图 ,乙物质的电子式是
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
(4)简述比较D与E金属性强弱的实验方法:
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用)其反应方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com