
题目列表(包括答案和解析)
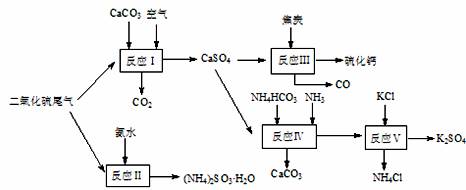
(10分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:

(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 ▲ 。
(2)下列有关说法正确的是 ▲ 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS
+4CO↑
CaS
+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 ▲ 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 ▲ 。
(10分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 ▲ 。
(2)下列有关说法正确的是 ▲ 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C![]() CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 ▲ 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 ▲ 。
(10分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 ▲ 。
(2)下列有关说法正确的是 ▲ 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C![]() CaS+4CO↑
CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 ▲ 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 ▲ 。
(10分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸 氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 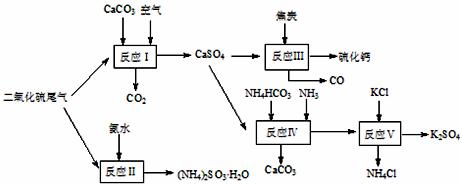
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液 中加入适量的对苯二酚等物质,其目的是 ▲ 。
中加入适量的对苯二酚等物质,其目的是 ▲ 。
(2)下列有关说法正确的是 ▲ 。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C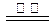 CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(1)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合 成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
① 生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式 。
② 反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质(已知对苯二酚具有很强的还原性),其作用可能是 。
③ 反应Ⅲ中氧化剂与还原剂的物质的量之比为 。
④ 能用于测定尾气中SO2含量的是 。
| A.滴有酚酞的NaOH溶液 | B.酸性KMnO4 |
| C.滴有淀粉的碘水 | D.BaCl2溶液. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com