
题目列表(包括答案和解析)
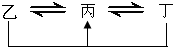 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:

元素周期表是学习和研究化学的重要工具。按要求回答下列问题:
A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素A可以和B形成A2B和A2B2两种分子;化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,乙是由元素D与E组成;化合物丙是由C与E组成的。
(1)元素B、D、E的元素符号依次为_______、_______、______。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的有___(填分子式)
(3)D的氧化物在高温下可以与C的碳酸盐发生反应,其化学反应方程式为________;化合物乙遇水剧烈反应有白雾生成,其反应的化学方程式为___________。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量为________;配制过程中除用到容量瓶外,还需要的玻璃仪器有___________________。电解所配制的400mL溶液,当电路中通过1mol电子时,理论上可收集到的气体在标准状况下的体积为_________L。
元素周期表是学习和研究化学的重要工具。按要求回答下列问题:
A、B、C、D、E是短周期元素,其原子序数依次增大。A、C两元素的最外层只有一个电子,C离子的电子层结构与周期表中非金属性最强的元素的阴离子的电子层结构相同;元素A可以和B形成A2B和A2B2两种分子;化合物甲和乙的每个分子中均含有5个原子,甲是由元素D与A组成,其分子的核外电子总数为18,乙是由元素D与E组成;化合物丙是由C与E组成的。
(1)元素B、D、E的元素符号依次为_______、_______、______。
(2)上述5种元素形成的分子中,除甲分子外,核外电子总数也为18的有___(填分子式)
(3)D的氧化物在高温下可以与C的碳酸盐发生反应,其化学反应方程式为________;化合物乙遇水剧烈反应有白雾生成,其反应的化学方程式为___________。
(4)用500mL容量瓶配制400mL 1mol/L的丙溶液,需要丙的质量为________;配制过程中除用到容量瓶外,还需要的玻璃仪器有___________________。电解所配制的400mL溶液,当电路中通过1mol电子时,理论上可收集到的气体在标准状况下的体积为_________L。
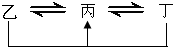 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题: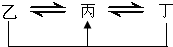
1―6 BADDCB;7―13 BCDCCBA;14―17 BCDC;18 CD;19 B;20 BC;21 ACD
 22.(18分)
22.(18分)
Ⅰ.(6分)
(1)
光路图2分
(2)在入射光线和折射光线任取两点,向法线作垂线,得

或者量取使得 ,向法线作垂线,则
,向法线作垂线,则
理由成立2分
表达式正确2分
Ⅱ.(12分)
 (Ⅰ)
(Ⅰ)
电路图4分
(2)电路中电压表选 A ,电流表选 C 。(填字母代号)
(3)实验中,当电流读数 时电压表读数
时电压表读数 ;当电流表读数
;当电流表读数 时电压表读数
时电压表读数 ,则可以求出
,则可以求出 ,
, (用
(用 、
、 、
、 、
、 及
及 表示)每空2分
表示)每空2分
23.(14分)
解:(1)由

解得: ………………………………………6分
………………………………………6分
(2)在地表: ,得
,得
加速上升时:
解得: ………………………………………5分
………………………………………5分
由:
∴
解得 ………………………………………3分
………………………………………3分
24.(18分)
解:(1)两者保持相对静止
对 :
:
对整体:
解得: ………………………………………3分
………………………………………3分
当 两者保持相对静止
两者保持相对静止
对整体: 

解得: ………………………………………3分
………………………………………3分
(2)当 时,
时,
对 :
:


对 :
:


解得: ,
,
 ………………………………………8分
………………………………………8分
(3)在1秒钟时两物体已经分开
 ………………………………………4分
………………………………………4分
25.(22分)
解(1)上金属板带负电………………………………………4分
(2)在电场中: ………………………………………4分
………………………………………4分
解得 ……………………………………2分
……………………………………2分
(3)在磁场中:磁偏转半径 ,磁场区域半径
,磁场区域半径 则
则
 ………………………………………2分
………………………………………2分
得: ………………………………………2分
………………………………………2分
由几何知识: ………………………………………4分
………………………………………4分
磁场区域最小面积: ………………………………………4分
………………………………………4分
26.(14分)每空2分
 (1)
(1)
 (2)
(2) (1分),酸性(1分),
(1分),酸性(1分), 
 ;
;
(3)
(4)①
②
③ (三个方程式顺序要正确才能给分)
(三个方程式顺序要正确才能给分)
27.(16分,每空2分)
(1)①②③(不写全得1分) ;漏斗、烧杯(“玻璃捧”写与不写不扣分)
(2)沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2~3次;
(3)钠离子和硫酸根离子(或硫酸钠)
(4)时间
(5)碱式
(6)取一根带火星的术条,伸入干燥管内,看木条是否复燃;
 (7)672
(7)672
28.(12分)(1) ;
;
(2) ;
;
(3)① (2分) ②(参看右图,2分)
(2分) ②(参看右图,2分)
(4)
(5)B
29.(16分)
(1) 溶液(1分)
溶液(1分)
(2)取代;(1分)

 (3)
(3)
(每个2分)
(4) (2分)
(2分)

 (5)③
(5)③
 |
|||
 |
|||
(2分)
 ⑥
⑥ (2分)
(2分)
(6)6种(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com