
题目列表(包括答案和解析)

| |||||||||||||||||||||||||||||||||
减少SO2的排放、回收利用SO2是环保的重要课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:

浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其它金属离子。
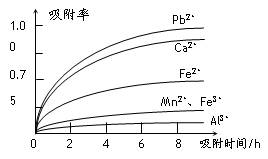
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
已知PbO2的氧化性强于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ,
氧化过程中主要反应的离子方程式 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至范围 ,
滤渣的主要成分有 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是
(填写序号)。
a.溶液的pH b.金属离子的氧化性 c.金属离子的半径 d.吸附时间
⑷ 操作a包括 过程。

| 离子 | 离子半径(pm) | 开始沉淀pH | 完全沉淀pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:

已知几种盐的溶解度随温度变化的
曲线如右图所示:

回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧 FeCO3生成产品 I的化学反应方程式为 _______。
实验室进行煅烧操作所需仪
器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向 (NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
C
B
D
A
D
A
D
C
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
B
D
BC
A
AD
C
BC
AC
AD
三、(本题包括3小题,共34分)
19.(12分)
(1)Fe2+ (1分)
(2)4FeCO3+O2/file:///E:\cooco.net.cn\docfiles\down\test\down\2ba40b05bbedafc4c92d1587190860dd.zip\67017\2009年广州市普通高中毕业班综合测试(一)\广东省广州市2009届高三第一次模拟考试(化学).files\image030.gif) 2Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
2Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
(3)K2SO4 (1分) 蒸发结晶、趁热过滤、洗涤、干燥(3分)
(4)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(3分)
20.(12分)
实验操作
预期现象和结论
步骤1:取少量浸取液于试管A中,逐滴滴加0.1 mol?L-1
NaOH溶液,充分振荡,边滴加边用pH 试纸检测溶液直至pH在4~9,静置。(3分)
有红褐色沉淀产生,说明浸取液中含 Fe3+。(1分)
步骤2:用滴管将试管A中上层清液转移至试管B,向试管B中滴加过量6 mol?L-1NaOH溶液,充分振荡,静置。(2分)
有白色沉淀产生,说明浸取液中含Mg2+。(1分)
步骤3:另取少量浸取液于试管C中,滴加过量6 mol?L-1
NaOH溶液,充分振荡,静置。(2分)
有沉淀产生。
步骤4:用滴管将试管C中上层清液转移至试管D,向试管D中逐滴滴加0.1 mol?L-1HCl至足量,边滴边振荡。(2分)
有白色沉淀产生然后沉淀又溶解,说明浸取液中含 Al3+。(1分)
21.(10分)
(1)(NH4)2B4O7 + 2HCl + 5H2O = 4 H3BO3 + 2NH4Cl (2分)
(2)圆底烧瓶 (1分)
安全管(或:防止装置中压力过大而发生危险;防止冷却时发生倒吸)(2分)
(3)消除其他试剂、实验操作等因素引起的误差 (2分)
(4)32.00 (1分) 4.480 (2分)
四、(本题包括3小题,共34分)
22.(12分)
(1)32(1分)
(2)2Fe3+ + Cu = 2Fe2+ + Cu2+ (2分) 铁粉、稀硫酸(2分)
(3)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体(2分)
(4)B (2分)
|