
题目列表(包括答案和解析)
 ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______.
 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准. ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______.铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是 ;
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。
|
|
① FeSO4还原Cr2O72-的离子方程式为 。
② Cr2 (SO4) 3溶液中加入过量NaOH浓溶液,反应的离子方程式为 。
③ 沉淀法分离废水中的Cr3+离子,pH应控制在 范围内。
④ 下列关于铬及其化合物的说法中正确的是 。
a.K2Cr2O7是一种常用的强氧化剂
b.NaCrO2溶液与AlCl3溶液混合有沉淀生成
c.酸性K2Cr2O7溶液可用于检验司机是否酒后驾车
d.金属铬硬度大、耐腐蚀,是常用的镀层金属
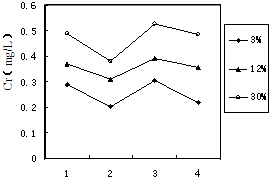
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:


我国规定“固体废弃物浸出标准值含铬不得超过10 mg·L-1”。分析图表,可得出多个结论:
① 实验取用的砖样是否符合上述标准: 。
② 还能得出的其它结论是(写出2条即可): ; 。
|
|
 Cr(OH)3
Cr(OH)3 CrO2-① FeSO4还原Cr2O72-的离子方程式为 。
CrO2-① FeSO4还原Cr2O72-的离子方程式为 。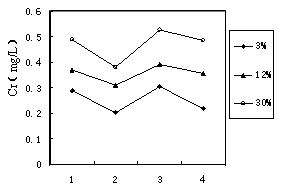
 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.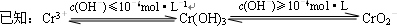 ①FeSO4还原Cr2O72-的离子方程式为
①FeSO4还原Cr2O72-的离子方程式为一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
C
B
D
A
D
A
D
C
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
B
D
BC
A
AD
C
BC
AC
AD
三、(本题包括3小题,共34分)
19.(12分)
(1)Fe2+ (1分)
(2)4FeCO3+O2/file:///E:\cooco.net.cn\docfiles\down\test\down\2ba40b05bbedafc4c92d1587190860dd.zip\67017\2009年广州市普通高中毕业班综合测试(一)\广东省广州市2009届高三第一次模拟考试(化学).files\image030.gif) 2Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
2Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
(3)K2SO4 (1分) 蒸发结晶、趁热过滤、洗涤、干燥(3分)
(4)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(3分)
20.(12分)
实验操作
预期现象和结论
步骤1:取少量浸取液于试管A中,逐滴滴加0.1 mol?L-1
NaOH溶液,充分振荡,边滴加边用pH 试纸检测溶液直至pH在4~9,静置。(3分)
有红褐色沉淀产生,说明浸取液中含 Fe3+。(1分)
步骤2:用滴管将试管A中上层清液转移至试管B,向试管B中滴加过量6 mol?L-1NaOH溶液,充分振荡,静置。(2分)
有白色沉淀产生,说明浸取液中含Mg2+。(1分)
步骤3:另取少量浸取液于试管C中,滴加过量6 mol?L-1
NaOH溶液,充分振荡,静置。(2分)
有沉淀产生。
步骤4:用滴管将试管C中上层清液转移至试管D,向试管D中逐滴滴加0.1 mol?L-1HCl至足量,边滴边振荡。(2分)
有白色沉淀产生然后沉淀又溶解,说明浸取液中含 Al3+。(1分)
21.(10分)
(1)(NH4)2B4O7 + 2HCl + 5H2O = 4 H3BO3 + 2NH4Cl (2分)
(2)圆底烧瓶 (1分)
安全管(或:防止装置中压力过大而发生危险;防止冷却时发生倒吸)(2分)
(3)消除其他试剂、实验操作等因素引起的误差 (2分)
(4)32.00 (1分) 4.480 (2分)
四、(本题包括3小题,共34分)
22.(12分)
(1)32(1分)
(2)2Fe3+ + Cu = 2Fe2+ + Cu2+ (2分) 铁粉、稀硫酸(2分)
(3)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体(2分)
(4)B (2分)
|