
题目列表(包括答案和解析)
合成氨工业的部分工艺流程如下图所示:
请你回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g);△H=–483.6kJ·mol-1
则N2(g)+3H2(g)2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
A.增大压强 B.降低温度 C.使用催化剂 D. 增大反应物的浓度
(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示:
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
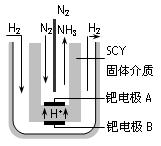
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如图)
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
合成氨工业的部分工艺流程如下图所示: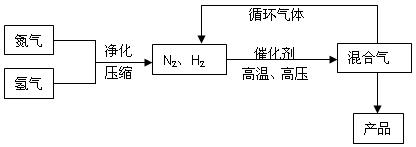
请你回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=–483.6kJ·mol-1
则N2(g)+3H2(g)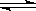 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
| A.增大压强 | B.降低温度 | C.使用催化剂 | D.增大反应物的浓度 |
合成氨工业的部分工艺流程如下图所示:
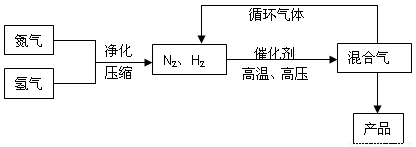
请你回答下列问题:
(1)已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ;△H=–483.6kJ·mol-1
则N2(g)+3H2(g) 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________。
A.增大压强 B.降低温度 C.使用催化剂 D. 增大反应物的浓度
(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示:
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如图)
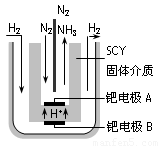
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
(14分)合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1
一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下: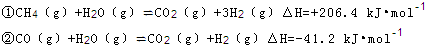
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
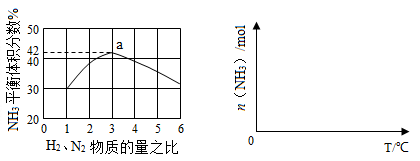
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。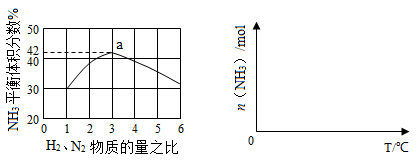
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
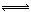 2NH3(g) ?H=—92.4kJ?mol?1
2NH3(g) ?H=—92.4kJ?mol?1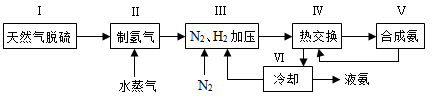
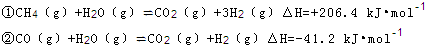
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
C
B
D
A
D
A
D
C
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
B
D
BC
A
AD
C
BC
AC
AD
三、(本题包括3小题,共34分)
19.(12分)
(1)Fe2+ (1分)
(2)4FeCO3+O2/file:///E:\cooco.net.cn\docfiles\down\test\down\2ba40b05bbedafc4c92d1587190860dd.zip\67017\2009年广州市普通高中毕业班综合测试(一)\广东省广州市2009届高三第一次模拟考试(化学).files\image030.gif) 2Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
2Fe2O3+4CO2 (2分) 坩埚、坩埚钳 (2分)
(3)K2SO4 (1分) 蒸发结晶、趁热过滤、洗涤、干燥(3分)
(4)滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液。(3分)
20.(12分)
实验操作
预期现象和结论
步骤1:取少量浸取液于试管A中,逐滴滴加0.1 mol?L-1
NaOH溶液,充分振荡,边滴加边用pH 试纸检测溶液直至pH在4~9,静置。(3分)
有红褐色沉淀产生,说明浸取液中含 Fe3+。(1分)
步骤2:用滴管将试管A中上层清液转移至试管B,向试管B中滴加过量6 mol?L-1NaOH溶液,充分振荡,静置。(2分)
有白色沉淀产生,说明浸取液中含Mg2+。(1分)
步骤3:另取少量浸取液于试管C中,滴加过量6 mol?L-1
NaOH溶液,充分振荡,静置。(2分)
有沉淀产生。
步骤4:用滴管将试管C中上层清液转移至试管D,向试管D中逐滴滴加0.1 mol?L-1HCl至足量,边滴边振荡。(2分)
有白色沉淀产生然后沉淀又溶解,说明浸取液中含 Al3+。(1分)
21.(10分)
(1)(NH4)2B4O7 + 2HCl + 5H2O = 4 H3BO3 + 2NH4Cl (2分)
(2)圆底烧瓶 (1分)
安全管(或:防止装置中压力过大而发生危险;防止冷却时发生倒吸)(2分)
(3)消除其他试剂、实验操作等因素引起的误差 (2分)
(4)32.00 (1分) 4.480 (2分)
四、(本题包括3小题,共34分)
22.(12分)
(1)32(1分)
(2)2Fe3+ + Cu = 2Fe2+ + Cu2+ (2分) 铁粉、稀硫酸(2分)
(3)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体(2分)
(4)B (2分)
|