某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去).
正确操作,记录得到下图2中部分实验数据.
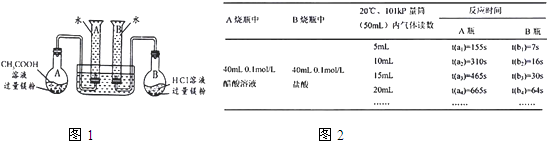
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)
量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)
;
经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
容量瓶(100mL)、玻璃棒
容量瓶(100mL)、玻璃棒
;
(3)在实验数据中
①t(a
1)远远大于t(b
1)的原因为:
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
;
②由
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
[用含t(b
1)、t(b
2)、t(b
3)代数式表示]说明盐酸是强酸,不存在电离平衡;由
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
[用含t(a
1)、t(a
2)、t(a
3)代数式表示]说明醋酸中存在电离平衡.
(4)该实验得到什么结论?(回答出两点即可)
①
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)
;
②
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
.
(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入
CH3COONa固体、水或NaCl溶液
CH3COONa固体、水或NaCl溶液
(填写两种不同作用原理的物质).

