
题目列表(包括答案和解析)
下列说法正确的是
A.实验室常用无水硫酸铜作气体干燥剂
B.工业上常用电解AlCl3,制备金属Al
C.CO2溶于水能导电,故CO2是电解质
D.NH4C1溶液中离子浓度大小关系为c(Cl-))>(NH )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
| ||
| ||
| ||
| ||



| ||
| ||
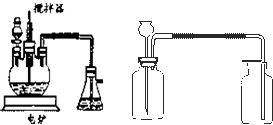
(13分)(1)如图所示装置,为实现下列实验目的,其中y端适合于作入口的是_____多项)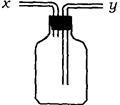
A 瓶内盛液体干燥剂,用以干燥气体
B 瓶内盛液体洗涤剂,用以除去某气体中的杂质
C 瓶内盛水,用以测量某难溶于水的气体的体积
D 瓶内贮存气体,加水时气体可被排出
E 收集密度比空气大的气体
F 收集密度比空气小的气体
(2) 浓H2SO4和木炭在加热时发生反应的化学方程式是_______________________。
图中虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,
填写下列空白。
①A中无水硫酸铜的作用_____________。
②证明SO2一定存在的现象是_____________。
③C中酸性KMnO4溶液的作用_____________。
④证明CO2一定存在的现象是_____________。
(13分)(1)如图所示装置,为实现下列实验目的,其中y端适合于作入口的是_____多项)
A 瓶内盛液体干燥剂,用以干燥气体
B 瓶内盛液体洗涤剂,用以除去某气体中的杂质
C 瓶内盛水,用以测量某难溶于水的气体的体积
D 瓶内贮存气体,加水时气体可被排出
E 收集密度比空气大的气体
F 收集密度比空气小的气体
(2) 浓H2SO4和木炭在加热时发生反应的化学方程式是_______________________。
图中虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,
填写下列空白。
①A中无水硫酸铜的作用_____________。
②证明SO2一定存在的现象是_____________。
③C中酸性KMnO4溶液的作用_____________。
④证明CO2一定存在的现象是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com