
题目列表(包括答案和解析)
蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。356g“可燃冰”(分子式为CH4?9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为 。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol.356 g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水放出的热量为________.
(2)已知氢气燃烧的热化学方程式为2H2(g)+O2(g)![]() 2H2O(l) ΔH=-571.6 kJ/mol,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)→3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol.试比较同质量的氢气和丙烷燃烧,产生的热量比值约为________.
2H2O(l) ΔH=-571.6 kJ/mol,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)→3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol.试比较同质量的氢气和丙烷燃烧,产生的热量比值约为________.
(12分)(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据: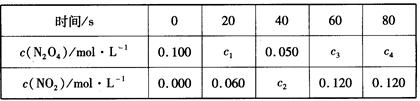
①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
| A.增大容器的容积 | B.再充入一定量的N2O4 |
| C.再充入一定量的NO2 | D.再充入一定量的He |
一、选择题:(4分×8=32分)
1、D 2、D 3、A 4、C 5、C 6、D 7、A 8、B
二、选择题:(4分×8=32分)
9、B 10、AD 11、A 12、BD 13、C 14、B 15、AD 16、D
三、(本题包括2小题,共22分)
17、(10分)(1)A、D(2分) (2)容量瓶(1分)
(3)C、D(2分) 溶解、过滤(2分) a.d.e.h.j (3分)
18、(12分)(1)E→D→B→C(2分) 2NH3+3CuO=3Cu+N2↑+3H2O(2分)
(2)N2的相对分子质量28与空气的平均相对分子质量相近(1分)。以塑料袋直接收集(1分)
(3)A (1分) 将分液漏斗上部活塞凹槽与口部小孔相对;检查装置的气密性;向烧瓶内加少许碎瓷片。(2分)
(4)方案3(1分) CuO和Cu可循环反复利用,节省药品(2分)
四、(本题包括2小题,共18分)
19、(8分)(1)BD(2分)(2)不能(1分) 正2价氮不能将负3价氮氧化至正3价氮(2分) (3)
20、(10分)(1)FeSO4?7H2O (3分) (2)野外焊接钢轨(1分)
(3)Cl2+SO2+2H2O=2Cl-+SO42-+4H+(2分)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(4)常温下浓硫酸使铝、铁钝化(2分)
五、(本题包括1小题,共10分)
21、(10分)(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=890.3kJ/mol(2分)
(2)放热(1分)由图知,不论在何种压强下,都是温度越高,CO的转化率越小(2分) O2+4e-=2O2-(2分) 负(1分)
(3)开发新能源,例如核能、太阳能等(1分),加大能源消耗大户的节能改造(1分)
六、本题包括2小题,共18分)
22、(9分)(1)CH3CH2COOCH3(1分)(2)加成,消去(2分)
(3)HCOOCH=CHCH3,HCOOCH2CH=CH2(2分)
 (4)CH≡CH+CO+H2O催化剂CH2=CHCOOH(2分)
(4)CH≡CH+CO+H2O催化剂CH2=CHCOOH(2分)



 nCH2=CHCOOCH3 催化剂 [CH2-CH]n (2分)
nCH2=CHCOOCH3 催化剂 [CH2-CH]n (2分)
COOCH3
23、(9分)(1)CH3 (2分) 光照(1分)
(2)烯烃与卤化氢(HCl)加成,H原子总是加在连接H原子较多的不饱和C原子上(H加H多)(2分)
消去HX时,X原子总是和含H原子较少的相邻碳原子上的H消去(H去H少)(2分)
 |
(3) (2分)
七、(本题包括2小题,共18分)
24、(8分)(1)1.379( 分) (2)
(1)b=
(2)m(400)=3.432
n(NaHCO3)=x mol, n(K2CO3)=y mol
84x+138y=3.432
x+y=0.028
84x0.028+54y=3.432
y=0.02
x=0.008
即 n(NaHCO3):n(K2CO3)=0.008:0.02
=2:5
(3)第三次实验的样品中:
n(NaHCO3)=0.008×3/4=0.006 mol
n(K2CO3)=0.02×3/4=0.015 mol
n[Ba(OH)2]=0.028 mol
=》n(OH-)=0.056 mol
反应中消耗OH-物质的量为0.006 mol
剩余OH-物质的量为0.056-0.006=0.05 mol
所取1/10滤液中n(OH-)=0.005 mol
稀释至500mL后 c(OH-)=0.005/0.5=0.01mol/L
pOH=2 pH=14-2=12
25、(10分)(1)5:3(4分)(2)2.42×
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com