
题目列表(包括答案和解析)
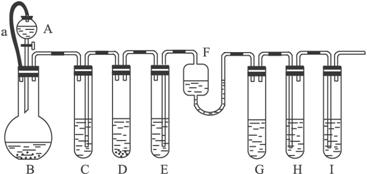
各装置中试剂或物质为:
A:2 mol·L-1 H2SO4 B:Zn C:2 mol·L-1 H2SO4和CuSO4混合液 D:Zn E:CuSO4 F:NH3·H2OG:30% H2O2 H:饱和的H2S溶液 I:NaOH溶液
已知:Cu2++4NH3·H2O====[Cu(NH3)4]2++4H2O,其产物可作H2O2分解的催化剂。
请完成下列问题:
(1)“化学多米诺实验”成功的关键之一是控制好第一个反应,关键之二是____________。
(2)B与D两容器中反应速率比较B______D(填“>”“<”或“=”=,原因是______
_________________________________________________。
(3)H中的现象是________________________________________。
(4)I的作用是(用离子方程式表示)____________________。
(5)A和B之间的导管a的作用是_____________________________。
(6)在该实验中不涉及的反应类型是(填序号)。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
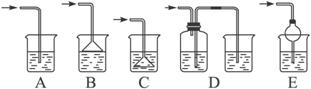
(7)如果从H中导出的气体是极易溶于水的气体,下列哪个装置能代替I?填序号______。
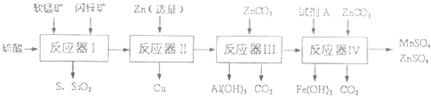
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
| 2mNA |
| M |
| 2mNA |
| M |

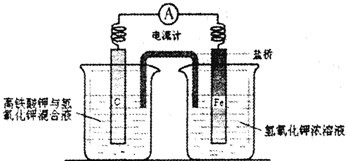
 Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物.
Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com