
题目列表(包括答案和解析)
(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血
剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图(标出电极材料和电解质溶液),并写出电极反应式。

正极反应 ,
负投反应 。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,以及一些必要条件,实现 Cu+H2SO4(稀)=CuSO4+H2↑反应。请在框内画出能够实现这一反应的实验装置图。

(4)另一位同学在做(3)反应实验时,看到碳棒和铜棒
上都有气泡产生,但铜棒没有被腐蚀。请你分析其原因
,
此时的总反应为 。
(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血
剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图(标出电极材料和电解质溶液),并写出电极反应式。

正极反应 ,
负投反应 。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,以及一些必要条件,实现 Cu+H2SO4(稀)=CuSO4+H2↑反应。请在框内画出能够实现这一反应的实验装置图。

(4)另一位同学在做(3)反应实验时,看到碳棒和铜棒
上都有气泡产生,但铜棒没有被腐蚀。请你分析其原因
,
此时的总反应为 。
CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。CuSO4∙5H2O的实验室制法如下:
Ⅰ.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀)

回答下列问题:
⑴用98%的浓硫酸配制溶解所用的4.5 mol∙L-1的稀硫酸,只需 种玻璃仪器
⑵步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是
发生反应的离子方程式:
⑶如何证明Fe2+已经充分转化?
⑷步骤④之后的实验操作是 ,所需仪器是铁架台(带铁圈)、
及抽滤装置。
Ⅱ.实验室用铜粉制备的CuSO4∙5H2O流程图如下:
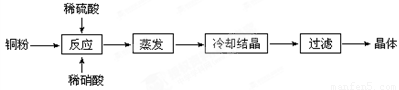
根据题意完成下列填空:
⑴理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为 ,
发生反应的离子方程式为 。
⑵实际制得的胆矾晶体中还是含有一些杂质,通常采用 法提纯。
⑶实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是
。
请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。

⑷上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是 。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血
剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图(标出电极材料和电解质溶液),并写出电极反应式。
正极反应 ,
负投反应 。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,以及一些必要条件,实现 Cu+H2SO4(稀)=CuSO4+H2↑反应。请在框内画出能够实现这一反应的实验装置图。
(4)另一位同学在做(3)反应实验时,看到碳棒和铜棒
上都有气泡产生,但铜棒没有被腐蚀。请你分析其原因
,
此时的总反应为 。




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com