
题目列表(包括答案和解析)
(1)若AgC1在水中、0.01mol·L-1CaCl2溶液中、0.01mol·L-1NaC1溶液中及0.05mol·L-1AgNO3溶液中的溶解度分别为S1、S2、S3、S4,则S1、S2、S3、S4由大到小的顺序为________.
(2)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
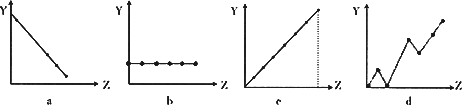
①ⅡA族元素的价电子数________;
②第3周期元素的最高化合价________;
③F-、Na+、Mg2+、Al3+的离子半径________.
 (1)原NaOH溶液的物质的量浓度为
(1)原NaOH溶液的物质的量浓度为| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(g) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com