
题目列表(包括答案和解析)
下表是元素周期的一部分,其中所列字母分别代表某一元素。
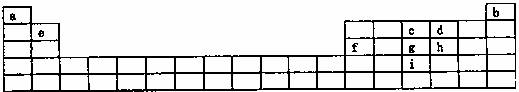
请根据表中所列a i九种元素,回答下列问题:
(1)基态原子的价电子层中,未成对电子数最多并且原子半径最小的元素的价电子层的电子排布式 ;当此元素的原子与a元素的原子形成简单的分子时,该元素的原子杂化方式 ,所形成简单分子的立体构型为 ,该分子为 分子(填“极性”或“非极性”)。
(2)d、g、I分别与a形成化合物,推断所形成的化合物沸点由高到低的排列顺序为
(填化学式)。

| 周期 族 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | |||||
| 4 | ⑥ | ⑦ | ⑧ |
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o |

主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com