
题目列表(包括答案和解析)
AgCl(固)![]() Ag++Cl-,Ag2CrO4(固)
Ag++Cl-,Ag2CrO4(固)![]() 2Ag++
2Ag++![]() ,在一定温度下,难溶化合物得饱和溶液的离子浓度的乘积为一常数,这个常数用Ksp表示。
,在一定温度下,难溶化合物得饱和溶液的离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10
Ksp(Ag2CrO4)={c(Ag+)}![]() )=1.9×10-12
)=1.9×10-12
现有0.001mol/L AgNO3溶液滴定0.001mol/LKCl和0.001mol/L的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和![]() 中哪种先沉淀?
中哪种先沉淀?
(2)当![]() 以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少?
以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少?![]() 与Cl-能否达到有效的分离?(设当一种离子开始沉淀,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
与Cl-能否达到有效的分离?(设当一种离子开始沉淀,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
硫化物据其溶解性可以分三类:①易溶于水的有
K2S、(NH4)2S等;②易溶于非氧化性强酸、不溶于水的有FeS、ZnS;③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS、Ag2S、CuS、Cu2S.其中,Ag2S、CuS、Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水(硝酸与盐酸的混合液).氢硫酸溶液中存在下列平衡: H2S(1)将硫化氢通入硫酸铜溶液中生成硫酸的原因是________.
(2)难溶电解质在水溶液里存在着溶解平衡,在常温下,溶液中各离子浓度其系数次方的乘积在一定温度下是一个常数,该常数叫溶度积(Ksp).溶液中各离子浓度(其系数次方)的乘积大于溶度积时则出现沉淀;反之沉淀溶解.已知在常温下,FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c(S2-)之间存在如下关系:[c(H+)]2·c(S2-)=1.0×10-22.在该温度下,将适量FeS投入硫化氢饱和溶液中,欲使溶液中c(Fe2+)为1 mol/L,应调节溶液的pH为________.
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| 元素 | Mn | Fe | |
| 电离能 (kJ・mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:
①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
 |
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 ,写出与CO互为等电子体的一种离子的化学式为 。
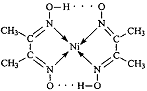 (2)右图配合物分子内的作用力除共价键外,还存在的两种作用 力是 (填编号)。
(2)右图配合物分子内的作用力除共价键外,还存在的两种作用 力是 (填编号)。
A.氢键 B.离子键 C. 范德华力 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。
如:①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形。
(4)Mn、Fe和Ni一样均为第四周期过渡元素,两元素的部分电离能数据如下表。
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
据此分析Mn2+比Fe2+ (填 “更易” 或“更难 ”)再失去-个电子,从微粒结构的角度简述其原因是 。
(5)NiO的晶体结构类型与氯化钠的相同,NiO晶胞中与Ni最近的Ni的数目为 个。
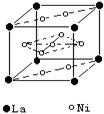 (6)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是______。
(6)氢气是新型清洁能源,镧(La)和镍的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一镍原子,其他镍原子都在晶胞面上。该晶体的化学式是______。
选做题
本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
20A.过渡元素在生活、生产和科技等方面有广泛的用途。
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为 。

(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是 。(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
|
元素 |
Mn |
Fe |
|
|
电离能 (kJ・mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用。现有铬(Ⅲ)与甲基丙烯酸根的配合物为:

①该化合物中存在的化学键类型有 。
②该化合物中一个Cr的配位数为 。
③甲基丙烯酸分子中C原子的杂化方式有 。
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是 。(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
____ 。(填元素符号)
 |
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡,待其溶解后,控制温度在85℃~90℃条件下反应5~10 min,然后冷却,即有乙酰水杨酸晶体析出。
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL饱和碳酸氢钠溶液,加完后继续搅拌2~3 min,直到没有二氧化碳气体产生为止。过滤,用5~10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4mol / L盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1~2次,再抽干水分,即得产品。
(1)第①步中,要控制温度在85℃~90℃,应采用的加热方法是 ,用这种方法加热需要的玻璃仪器有 。
(2)在第②步中,用冷水洗涤晶体,其目的是 、 。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是 ,加入盐酸的作用是 。
(4)如何检验产品中是否混有水杨酸? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com