
题目列表(包括答案和解析)
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
| 实验步骤 | 实现现象 | 反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液。 |
| ① |
| 过滤,往所得滤液中通入过量二氧化碳, | ② | ③ |
| 继续加入过量稀盐酸 | ④ |
|
II、牙膏样品中碳酸钙的定量测定
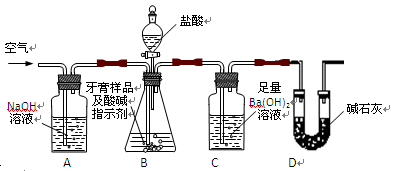
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是:
。
(3)、C中反应生成BaCO3的化学方程式是 。
(4)、下列各项措施中,不能提高测定准确度的是 (填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)、实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为 。
(6)、某同学提出将C中的Ba(OH)2换成浓H2SO4 ,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
| 实验步骤 | 实现现象 | 反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液。 | | ① |
| 过滤,往所得滤液中通入过量二氧化碳, | ② | ③ |
| 继续加入过量稀盐酸 | ④ | |
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
|
实验步骤 |
实现现象 |
反应的离子方程式 |
|
往滤渣中加入过量NaOH溶液。 |
|
① |
|
过滤,往所得滤液中通入过量二氧化碳, |
② |
③ |
|
继续加入过量稀盐酸 |
④ |
|
II、牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
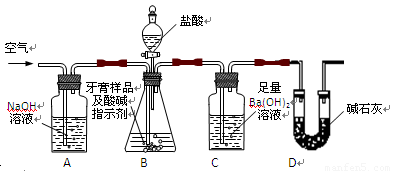
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是:
。
(3)、C中反应生成BaCO3的化学方程式是 。
(4)、下列各项措施中,不能提高测定准确度的是 (填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)、实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为 。
(6)、某同学提出将C中的Ba(OH)2换成浓H2SO4 ,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com