
题目列表(包括答案和解析)

试完成下列问题:
(1)粗盐中含有Ca2+、Mg2+、![]() 等杂质,精制后可得NaCl饱和溶液。精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液;最后加入盐酸至溶液呈中性。请写出加入盐酸后可能发生的化学反应的离子方程式为______________________。
等杂质,精制后可得NaCl饱和溶液。精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液;最后加入盐酸至溶液呈中性。请写出加入盐酸后可能发生的化学反应的离子方程式为______________________。
(2)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度思考,在母液里加入石灰乳起的作用是_________________________________________________________。
(3)海水里的镁元素处于游离态还是化合态?________________,从海水中提取氯化镁的反应是不是氧化还原反应?_______________,用电解法冶炼金属镁的反应是不是氧化还原反应?_______________,原因是______________________________________________。
(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁。请思考镁蒸气可以在下列哪种气体氛围中冷却_______________。
A.H2 B.CO
请根据上面的溶度积解答下列问题:
(1)把海水滤去悬浮杂质后,向海水中加入某种化学试剂,将Mg2+转化为沉淀.该化学试剂是利用了海边的贝壳(主要成分为CaCO3)制成,________(填“能”或“不能”)直接把贝壳研磨成粉末,撒入海水中使Mg2+转化为沉淀,其原因是________.
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,这种做法的理由是________,请你推测应把贝壳做怎样的加工处理________.
(3)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为________(填“可以”或“不可以”).在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他________(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是________.
(4)氢氧化镁不是海水提镁的最终物质,最终制备的是金属镁,所以需要将氢氧化镁转化为镁的某种化合物,然后将其加热熔融后电解,下面是几种镁的化合物的熔点:

过滤出
Mg(OH)2沉淀后,用什么试剂________(填化学式)将其溶解,你选择该试剂的理由是________.(5)将得到的氯化镁溶液在浓缩池中制得MgCl2·6H2O.然后将MgCl2·6H2O转移到干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O,才能得到无水MgCl2,其原因是________.
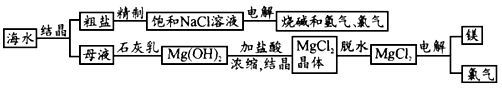
海水中有非常丰富的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源综合利用的示意图.
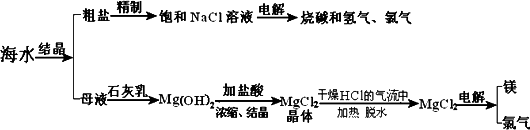
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入盐酸后可能发生的化学反应的离子方程式_________________.
(2)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液中加入石灰乳起什么作用?_________________;
Mg(OH)2沉淀中混有Ca(OH)2应该怎样除去?写出实验步骤:_________________.
(3)海水中的镁元素处于游离态还是化合态?________;从海水中提取MgCl2的反应是不是氧化还原反应?________;用电解法冶炼金属镁的反应是不是氧化还原反应?_________________.
(4)用电解法制取金属镁时,需要无水氯化镁.在干燥的HCl气流中加热
MgCl2·6H2O时,能得到无水MgCl2,其原因是________.
(5)电解无水氯化镁所得的镁蒸汽冷却后即为固体镁.请思考镁蒸汽可以在下列哪种气体氛围中冷却?_________________
A、H2
B、CO2
C、空气
D、O2
E、Ar
(6)实验室里将粗盐精制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:________________
过滤时:________________
蒸发时:________________
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源的综合利用的示意图.
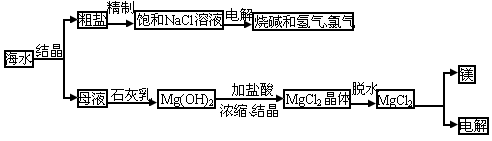
试回答下列问题:
(1)粗盐中含有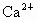 、
、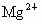 、
、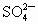 等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的
等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的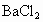 溶液、过量的NaOH溶液和过量的
溶液、过量的NaOH溶液和过量的 溶液,最后加入盐酸至溶液呈中性.
溶液,最后加入盐酸至溶液呈中性.
请写出加入盐酸后可能发生的化学反应的离子方程式:______________.
(2)海水提取食盐后的母液中有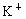 、
、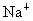 、
、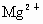 等阳离子.从离子反应的角度思考,在母液里加入石灰乳起什么作用?
等阳离子.从离子反应的角度思考,在母液里加入石灰乳起什么作用?
(3)海水里的镁元素处于游离态还是化合态?从海水中提取氯化镁的反应是不是氧化还原反应?用电解法冶炼金属镁的反应是不是氧化还原反应?为什么?
(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁。请思考镁蒸气可以在下列哪种气体氛围中冷却( )
A.H2 B.CO2 C.空气 D.O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com