
题目列表(包括答案和解析)
(8分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1______,E2______(填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g);△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
【解析】(1)根据反应进程可判断反应物的能量高,生成物的能量低,所以热化学方程式为N2(g)+3H2(g)2NH3(g) △H=-92 kJ/mol。
(2)反应热就是断键吸收的能量和成键所放出的能量的差值,所以有943kJ/mol+3×435kJ/mol-2×3×x=-92 kJ/mol ,解得x=390 kJ/mol。
(3)催化剂能降低反应的活化能,但不能改变反应热,所以E1和E2均减小。
(4)考查盖斯定律的应用,将已知的2个热化学方程式叠加即得到
4NH3+6NO=6H2O+5N2 △H=(a-3b)kJ/mol。所以1mol NH3还原NO至N2,则该反应过程中的反应热![]() kJ/mol。
kJ/mol。
(8分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,

(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
|
化学键 |
H-H |
N≡N |
|
键能/kJ·mol-1 |
435 |
943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1______,E2______(填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
;△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
【解析】(1)根据反应进程可判断反应物的能量高,生成物的能量低,所以热化学方程式为N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol。
2NH3(g) △H=-92 kJ/mol。
(2)反应热就是断键吸收的能量和成键所放出的能量的差值,所以有943kJ/mol+3×435 kJ/mol-2×3×x=-92 kJ/mol ,解得x=390 kJ/mol。
(3)催化剂能降低反应的活化能,但不能改变反应热,所以E1和E2均减小。
(4)考查盖斯定律的应用,将已知的2个热化学方程式叠加即得到
4NH3+6NO=6H2O+5N2 △H=(a-3b)kJ/mol。所以1mol NH3还原NO至N2,则该反应过程中的反应热 kJ/mol。
kJ/mol。
解析:将乙醛的分子式作如下变形:C2H4O![]() C2H2·H2O。该混合物可表示为:
C2H2·H2O。该混合物可表示为:
![]() ·H2O,假设混合物质量为100 g,则m (C)=100 g×72%=72 g又方框内有n(C)∶n(H)=1∶1,那么方框内总质量应为72
g×(12+1)/12=78
g,则方框外H2O的质量为100 g-78 g=22 g,故求得m (O)=22 g×
·H2O,假设混合物质量为100 g,则m (C)=100 g×72%=72 g又方框内有n(C)∶n(H)=1∶1,那么方框内总质量应为72
g×(12+1)/12=78
g,则方框外H2O的质量为100 g-78 g=22 g,故求得m (O)=22 g×![]() =19.6 g,所以该混合物中氧的质量分数为
=19.6 g,所以该混合物中氧的质量分数为![]() ×100%=19.6%。
×100%=19.6%。
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是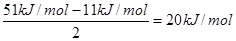 。
。
(16分)A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D 最外层电子数之比为2:3。试回答下列问题:
(1)A元素的名称是 ,E元素在周期表中的位置是 ;
(2)C、D、F的气态氢化物稳定性由强到弱的顺序是 (填化学式);
(3)E单质在足量D单质中燃烧生成的化合物的电子式是 ;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于 化合物(填“离子”或“共价”);
②X与Y的水溶液相混合发生反应的离子方程式为 ;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为: 。
(6)在A2D晶体中,每个分子与相邻的4个分子形成氢键,已知该晶体的升华热(晶体直接变成同温度气体时需要吸收的热量,叫做该晶体的升华热)是51 kJ/mol,除氢键外,分子间还存在范德华力(11 kJ/mol),则该晶体中氢键的“键能”是____kJ/mol;
【解析】原子核内无中子只有H,则A是氢元素。A和E,且E的原子序数大于B、C、D的,所以E只能是Na。B与D 最外层电子数之比为2:3,因为D的原子序数小于Na的所以D位于第二周期。若B与D 最外层电子数就是2和 3,则C就不能存在,所以B与D 最外层电子数就是4和6,即B是C,D是O,则C是N,F是S。
(1)略
(2)非金属性越强,氢化物的稳定性就越强,非金属性是O>N>S。
(3)钠的燃烧产物是过氧化钠,含有离子键和非极性键。
(4)钠是活泼的金属,所以由H、O、Na、S形成的化合物一定是离子化合物,它们分别为NaHSO4和NaHSO3。
(5)Na2S中S的化合价处于最低价态,具有还原性,而双氧水具有氧化性,二者分数氧化还原反应。
(6)每个水分子与相邻的4个分子形成氢键,则平均每个水分子形成的氢键是2个,所以氢键键能是![]() 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com