
题目列表(包括答案和解析)
为证明化学反应有一定的限度,进行如下探究活动:
I.取5m1 0.1mol/L的KI溶液,滴加“滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)
Ⅱ.继续加入2ml CCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为_____________________________________________
探究活动Ⅱ的实验现象为_______________________________________________
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息。现设计以下实验方案验证猜想:
①请完成下表
|
实验操作 |
现象和结论 |
|
步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] |
若_________,则猜想一不成立。 |
|
步骤二:往探究Ⅲ所得溶液中加入少量乙 醚,充分振荡、静置分层 |
若乙醚层呈血红色,则___________。 |
②写出实验操作“步骤—"中反应的离子方程式:_______________________________。
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液作指示剂,再用c mol/L KI标准溶液 滴定,达到滴定终点时的现象是_______________________________________________。
②重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则FeCl3稀溶液物质的量浓度为________mol/L。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______ (填“偏高”或“偏低,,或“不变”)。

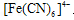 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,请你设计以下实验验证猜想:
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,请你设计以下实验验证猜想: 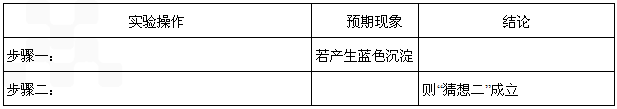
为证明化学反应有一定的限度,进行如下探究活动:
I.取5m1 0.1mol/L的KI溶液,滴加“滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)
Ⅱ.继续加入2ml CCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为_____________________________________________
探究活动Ⅱ的实验现象为_______________________________________________
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6] 4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息。现设计以下实验方案验证猜想:
①请完成下表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若_________,则猜想一不成立。 |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙 醚,充分振荡、静置分层 | 若乙醚层呈血红色,则___________。 |
|
下列情况不能用勒夏特列原理解释的是 | |
| [ ] | |
A. |
新制的氯水受光照,溶液酸性增强 |
B. |
用浓氨水和NaOH固体快速制取氨气 |
C. |
向红色的Fe(SCN)3溶液中加入少量KSCN固体,溶液颜色加深 |
D. |
合成氨工业中采用500℃的高温以提高单位时间内NH3的产量 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com