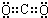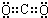分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液).
(1)电解质A的化学式为Na
nB,测得浓度为c mol/L的A溶液的pH=a.
①当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)
Bn-+H2O?HB(n-1)-+OH-
Bn-+H2O?HB(n-1)-+OH-
.
②当a=10,n=1时,A溶液中各种离子浓度由大到小的顺序为
c(Na+)>c(B-)>c(OH-)>c(H+)
c(Na+)>c(B-)>c(OH-)>c(H+)
,c(OH
-)-c(HB)=
1×10-10
1×10-10
mol/L.
当a=11,n=2时,A溶液中各种离子浓度由大到小的顺序为
c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-)
c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-)
,当a=9,n=2时,NaHB的溶液中各种离子浓度由大到小的顺序为
c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-)
c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-)
,当a=6,n=2时,NaHB溶液呈酸性的原因是(用离子方式程式表示)
HB-+H2O?B2-+H3O+
HB-+H2O?B2-+H3O+
,NaHB的溶液中各种离子浓度由大到小的顺序为
c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
.
③当n=1、c=0.1,溶液中c(HB):c(B
-)=1:99时,A溶液的pH为
11
11
(保留整数值).
(2)已知难溶电解质A的化学式为X
2Y
3,测得其饱和溶液中X
3+离子的浓度为c mol/L,则该难溶物X
2Y
3的溶度积常数为K
sp=
.

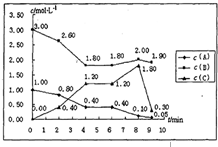 在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示:
在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示: