
题目列表(包括答案和解析)
某化学实验小组制备硫酸亚铁铵晶体并设计实验测定其组成,他们进行了以下实验。
Ⅰ.向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到一种浅蓝绿色的硫酸亚铁铵晶体,这种晶体俗名“摩尔盐”,它比绿矾稳定得多。将摩尔盐低温烘干后,称取7.84 g加热至100 ℃失去结晶水,质量变为5.68 g。
Ⅱ.选择图所示的部分装置连接起来,检查气密性后,将上述5.68 g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。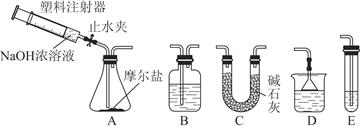
Ⅲ.向A中加入适量3%的H2O2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。
根据上述实验回答下列问题:
(1)实验Ⅰ中,“一系列操作”依次为________、________和过滤,要检验FeSO4溶液中是否含有Fe3+常用的试剂是________。
(2)实验Ⅱ中,选择的装置是A接________接________(填代号),A装置中未使用分液漏斗的理由是____________________________________________________________
(3)向锥形瓶中加入NaOH溶液的操作方法是_________________________________________________________
吸收A中产生的气体所用试剂应是________;实验小组的同学为保证A中产生的气体被完全吸收,以准确测量其质量,他们在A中反应停止后再进行的操作是__________________________________________________________
(4)根据上述实验数据计算,此摩尔盐中,n(NH4+)∶n(Fe2+)∶n(SO42—)∶n(H2O)=____________。







湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com