
题目列表(包括答案和解析)
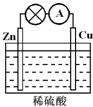

 能源是现代社会发展的支柱之一,化学能是重要的能源.
能源是现代社会发展的支柱之一,化学能是重要的能源.
(1)航天技术上使用的氢―氧燃料电池具有高能、轻便和不污染环境等优点。氢―氧燃料电池有酸式和碱式两种,它们放电时的电池总反应为: 2H2 + O2 = 2 H2O 。酸式氢―氧燃料电池的电解质是酸,其负极反应可表示为: 2H2 4e- = 4 H+,其正极反应表示为___________ ;碱式氢―氧燃料电池中的电解质是碱,其正极反应表示为: O2 +2H2O+4e-=4OH-,则其负极反应可表示为:
(2)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,正极板上覆盖PbO2,
负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是__________________________
充电时:阴极的电极反应式是
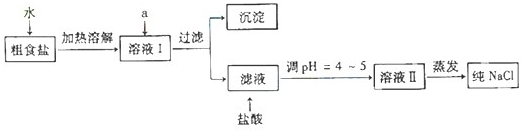
(3)现代工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请
回答下列问题:
①该过程总的离子反应方程式为:
电解之前,食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使
用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸, 其合理的加入顺序为
_________________(填试剂序号)。
②离子交换膜的作用是 。
 ③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
③现设计一电解装置如右图,用离子交换膜A和B将电解槽分为I、II、
Ⅲ三个区域,A为“阳离子交换膜”,它有一特殊的功能――只允许阳
离子通过,但阻止阴离子和气体通过,而B是“阴离子交换膜”,它只
允许阴离子通过,可阻止阳离子和气体通过,电极均为惰性电极。若在I区投入Na2SO4
溶液,通电电解。阴极的电极反应式为_____________________________,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com