
题目列表(包括答案和解析)
| ||
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4?FeSO4?6H2O,商品名称为莫尔盐,是一种复盐.一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定.与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体.三种盐的溶解度(单位为g/100gH2O)见下表:
| 温度℃ | FeSO4?7H2O | (NH4)2SO4 | |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78,0 | 28.1 |
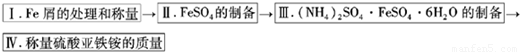
实验用品:10%Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4、蒸馏水、无水乙醇.
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为______,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______g(用含m1和m2的代数式表示,要求化简,下同.)水配制成室温下( 20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止.放置冷却,得到硫酸亚铁铵的晶体,过滤后用______洗涤晶体.
(4)称量生成的硫酸亚铁铵的质量,理论上为______g.
| 温度℃ | FeSO4?7H2O | (NH4)2SO4 | |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78,0 | 28.1 |
亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
|
滴定次数 |
1 |
2 |
3 |
4 |
|
KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。

| 无水AlCl3 |
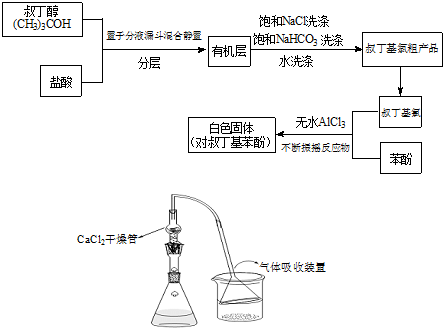
 +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
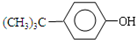 +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
 +HCl
+HCl湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com