
题目列表(包括答案和解析)
氨气作为一种重要的化工原料,主要用于生产氮肥、硝酸、纯碱、尿素等化工产品。下图是合成氨,并联合生产硝酸、纯碱、尿素的简要流程示意图:

反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
(1)设备A的名称是 ,副产物B的化学式是
(2)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度至少降低到 ℃(填具体温度),使 分离出来,循环使用的气体有 。
(3)已知尿素的结构简式为![]() 反应②的化学方程式是 。
反应②的化学方程式是 。
|
(5)已知:4NH3+3O2 ![]() 2N2 + 6H2O ,以此设计的氨燃料电池的负极电极反应式为_____________________________(电极材料均为惰性电极,KOH溶液作电解质溶液)。
2N2 + 6H2O ,以此设计的氨燃料电池的负极电极反应式为_____________________________(电极材料均为惰性电极,KOH溶液作电解质溶液)。
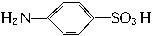
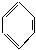
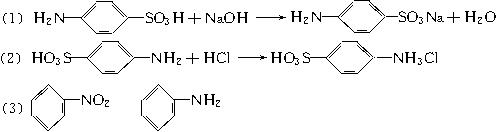 )是一种重要的化工原料,它具有两性,既能和氢氧化钠溶液反应,也可和盐酸反应。工业上常用苯为原料来合成对氨基苯磺酸。请回答下列问题:
)是一种重要的化工原料,它具有两性,既能和氢氧化钠溶液反应,也可和盐酸反应。工业上常用苯为原料来合成对氨基苯磺酸。请回答下列问题:(1)请写出对氨基苯磺酸和氢氧化钠溶液反应的化学方程式:_______________________。
(2)请写出对氨基苯磺酸和盐酸反应的化学方程式:_______________________________。
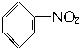
(3)已知下列(Ⅰ)—(Ⅳ)四个有机反应:
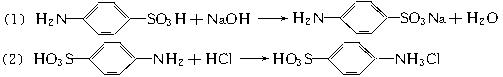
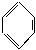
根据上述信息,试完成以下合成路线:
写出上述合成路线,A、B的结构简式A:____________,B:____________。
步骤(1)的反应条件是____________;上述(Ⅳ)反应是氧化反应还是还原反应?____________。
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
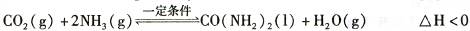
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
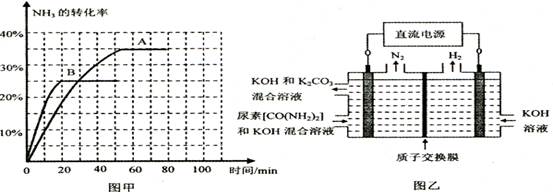
| ||
| ||
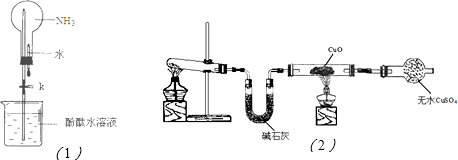
| ||
| ||
 ;
; ;
;| H+ |
(10分) 氨气是一种重要的化工原料,工业上用N2和H2合成NH3。现已知N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量变化示意图如下左图。回答下列问题: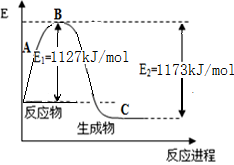
(1)该反应为 (填“吸热”或“放热”)反应。
(2)合成氨的热化学方程式为 。
(3)若又已知键能数据如上表,结合以上数据求出N-H键键能为 kJ/mol。
(4)工业上,以氨气为原料生产硝酸的第一步为氨催化氧化,请写出该反应的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com