
题目列表(包括答案和解析)
下列关于容量瓶的特点和使用的叙述正确的是
[ ]
A.容量瓶分圆底和平底两种
B.使用前一定要检验它是否漏水
C.定容时,加蒸馏水至接近标线2~3mm处,改用胶头滴管滴加
D.配制一定物质的量浓度溶液的实验需使用玻璃棒
下列关于容量瓶的特点和使用的叙述正确的是
[ ]
A.容量瓶分圆底和平底两种
B.使用前一定要检验它是否漏水
C.定容时,加蒸馏水至接近标线2~3mm处,改用胶头滴管滴加
D.配制一定物质的量浓度溶液的实验需使用玻璃棒
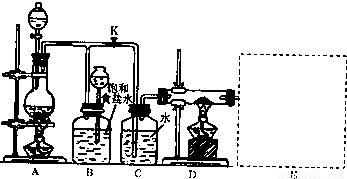
我校化学兴趣小组拟通过中和滴定实验验证某品牌陈醋的酸度。
(1)查阅资料:
①食醋组成极为复杂,除水以外的主要成分是醋酸CH3COOH,此外还有其他各种有机物和一些无机物等微量成分,醋酸的含量远远多于其他成分的含量。另外其中含一些色素成分,使食醋呈棕色(白醋除外)。
②0.1mol/L醋酸与氢氧化钠反应的滴定终点的pH约为________________
A 5.6 B 7.0 C 8.8 D 13.0
③包装显示该陈醋的酸度约是3.6g/100mL
(2)由以上资料,同学们认为:
①测量时可以忽略老陈醋其他成分特别是有机酸所带来的影响。
②根据陈醋的特点,只能选用______________来指示滴定终点。
A 甲基橙 B 酚酞 C 石蕊 D pH计
③为使滴定时溶液中的醋酸浓度接近0.1mol/L,应将10ml样品醋稀释至____________。
A 36 ml B 60 ml C 360 ml D 600 ml
(3)配制标准氢氧化钠溶液
由于NaOH在称量过程中极易吸水,配好的溶液浓度往往比预期偏小。故实验小组先用0.1010 mol/L 的KHP标准溶液准确测定NaOH溶液的浓度(KHP与NaOH按物质的量比1:1完全反应)。向锥形瓶中盛入20.00ml NaOH溶液时,应用______________量取。
A. 20ml 的量筒 B. 100ml 的容量瓶 C.碱式滴定管 D. 酸式滴定管
| V(NaOH) | V(KHP)平均 |
| 20.00 mL | 18.00 mL |
(4)用标准氢氧化钠溶液测定醋酸的浓度,并换算为酸度。
| V(稀释后的醋) | V(NaOH)平均 |
| 18.00 mL | 20.00 mL |
计算得出该陈醋样品的酸度为______________g/100mL。(计算结果保留4为有效数字)
 (1)①要配制500mL 0.200mol?L-1的H2SO4溶液,需要的仪器除量筒、烧杯外还有
(1)①要配制500mL 0.200mol?L-1的H2SO4溶液,需要的仪器除量筒、烧杯外还有
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com