
题目列表(包括答案和解析)
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴(3分)随着工业化、城镇化的快速发展,我们所生存的环境也面临越来越严峻的污染问题,如酸雨的形成、汽车尾气污染、工业废气污染、大量生活垃圾的产生等。
①下列措施不能够改善环境质量的是 (填字母)。
a.对所有垃圾通过露天焚烧的方式进行处理
b.给汽车排气管加装尾气催化净化装置以减少尾气污染
c.在煤炭中添加生石灰以减少酸雨的发生
②城市空气质量监测中,不需要监测的指标的是 (填字母)。
a.SO2浓度 b.NOx浓度 c.可吸入颗粒物的含量 d.CO2浓度
③现代人已经进入以“室内污染”为标志的第三个污染阶段,以下不属于室内污染物的是
(填字母)。
a.烹饪时产生的油烟 b.石材缓慢释放的放射性气体
c.各种板材中粘合剂释放的甲醛等 d.天然气燃烧产生的CO2和水
⑵(6分)化学与新材料开发密切关联,化学是人类进步的关键。

①近日,《中国航空报》透露了一条重大消息,中国在先进高温合金领域不断获得重大成果。可以说,没有高温合金,就没有今天先进的航空发动机。下列物质中不属于合金的是 (填字母)。
a.硬铝 b.玻璃钢 c.不锈钢 d.黄铜
②新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于 (填“合成纤维”、“合成橡胶”或“塑料”)材料。环保型聚乙烯塑料袋可以用于食品包装,合成该聚合物的反应可表示为 。
③随着电解工业的发展,铝制品已经被人类广泛使用,但是常温下不可以用铝制容器盛装的是 (填字母)。
a.浓氢氧化钠溶液 b.浓硫酸 c.浓硝酸 d.啤酒
在室外,不能将铜质电线和铝质电线直接相连接,否则会因发生 腐蚀而形成安全隐患。
⑶(6分)合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有 性。
② (填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是 (填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入 (填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是 (填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是 。
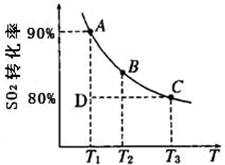 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.| 1 | 2 |
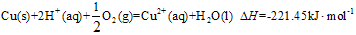

 。一定条件下,SO2的平衡转化率和温度的关系如图所示。该反应的ΔH _______0(填“>”或“<”)。反应进行到状态D时,v正________ v逆(填“>”、“<”或“=”)。?
。一定条件下,SO2的平衡转化率和温度的关系如图所示。该反应的ΔH _______0(填“>”或“<”)。反应进行到状态D时,v正________ v逆(填“>”、“<”或“=”)。? 
 2SO3(g)的平衡常数K=_________。
2SO3(g)的平衡常数K=_________。(本题16分)
(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
 物质 物质T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |

 ΔH >0
ΔH >0| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。(1)下列实验操作或对实验事实的叙述中存在错误的是____________(填序号)。
A.用50 mL酸式滴定管准确量取25.00 mL KMnO4酸性溶液,放入锥形瓶中待用
B.在测定硫酸铜晶体的结晶水含量时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C.中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D.实验室中进行的下列实验均需水浴加热:
①苯的硝化反应 ②葡萄糖的银镜反应 ③乙酸乙酯的制备 ④淀粉、纤维素的水解
E.配制1 mol·L-1的NaOH溶液时,下列操作均会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
(2)某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100 cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其他夹持装置已略去。(不考虑可逆反应)
操作步骤:
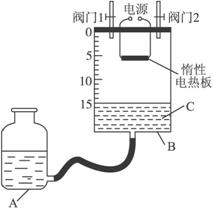
①检查装置的气密性
②将0.5 g红磷平铺在电热板上,盖紧容器
③打开阀门1、阀门2,从A的瓶口加入液体C,使B中液面至刻度15.0 cm
④向B中充入氯气,待氯气充满后关闭阀门1、阀门2,通电加热红磷……
请回答下列问题:
(i)检查装置气密性具体方法是____________________。
(ii)实验步骤③加入的液体C是____________(填名称)。
(iii)反应结束并充分冷却后,读取B中液面刻度读数时,应注意________________________;若液面在刻度5.6 cm处,此时实验条件近似看作标准状况,则生成物PClx中x的值是____________(计算结果保留1位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com