
题目列表(包括答案和解析)
已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )
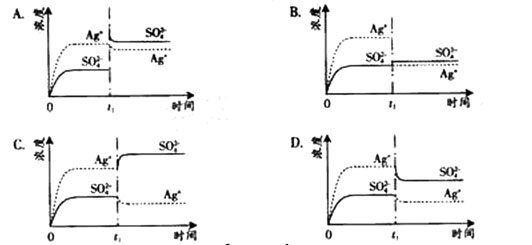
已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO![]() 浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO
浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO![]() 浓度随时间变化关系的是( )
浓度随时间变化关系的是( )
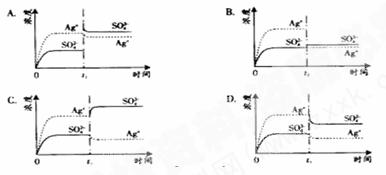
已知Ag2SO4的KW为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )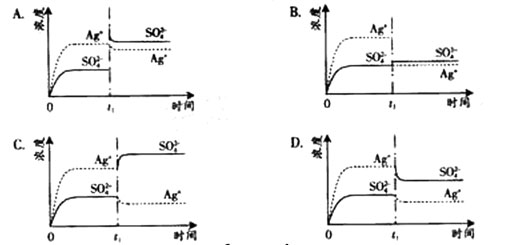
|
有关物质的量浓度溶液配制的下列说法中正确的是 | |
| [ ] | |
A. |
把1 mol NaCl溶于1 L水中所得溶液物质的量浓度为1 mol·L-1 |
B. |
把0.1 mol NaCl投入100 mL容量瓶中加水至刻度线,充分振荡后,浓度为1 mol·L-1 |
C. |
把4.0 g NaOH放入烧杯并加水搅拌冷却后全部转接到1000 mL容量瓶并加水至刻度,所得溶液的浓度为1 mol·L-1 |
D. |
需要480 mL 0.1 mol·L-1的Na2CO3溶液,配制时应选用500 mL容量瓶 |
 (08年广东卷)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO
(08年广东卷)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO![]() 浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol?L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol?L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO
浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol?L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol?L-1 Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO![]() 浓度随时间变化关系的是()
浓度随时间变化关系的是()

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com