
题目列表(包括答案和解析)
28.下图对三种不同类型汽车(以序号1、2、3表示)的废气排放情况进行了比较,这三种汽车分别是以汽油为燃料的汽车、以天然气(主要成份是甲烷)为燃料的汽车和电动汽车。请判断其中序号为1的是
汽车,序号为3的是 汽车。
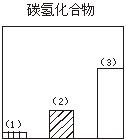
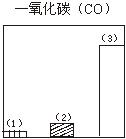
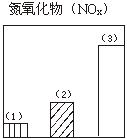
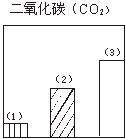
29.图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。试回答:
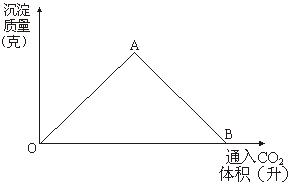
OA段曲线和AB段曲线所表示的反应方程式是
OA:
AB:
A点时已参加反应的CO2和Ca(OH)2的物质的量之比为 。
B处溶液中存在的浓度较大的两种离子是 和 。(填离子符号)
将B处生成的溶液煮沸,可见到的现象是 。
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g 。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体)。下列 分析或结果错误的是
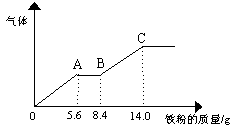 | |
A.原混合酸中NO3- 物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为
Fe + 2Fe3+ = 3Fe2+, BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4 浓度为2.5 mol?L-1
将甲和乙两种物质混合反应(反应可加热),将所得的气体通入适量的丙溶液中,丙溶液中不能产生明显现象的是( )
|
A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
A 单质在自然界中硬度最大
B 原子中s能级与p能级电子数相等且有单电子
C C在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540
D 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物
E 单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物
(1)常温下,某气态单质甲分子与AB分子互为等电子体,则一个甲分子中包含 个π键。
(2)关于B的氢化物,中心原子的杂化类型是 ,分子的空间构型 ,其
熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是 。
(3)D元素原子核外有 种运动状态不同的电子。当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为: 。
(4)E元素基态原子的价电子排布式 。E晶体中微粒的堆积方式是
。
A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
| A | 单质在自然界中硬度最大 |
| B | 原子中s能级与p能级电子数相等且有单电子 |
| C | C在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
| D | 单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
| E | 单质是一种常见金属,与B元素能形成黑色和砖红色两种氧化物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com