
题目列表(包括答案和解析)
某学生在A、B、C、D四支小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝(使细铁丝完全浸没在食盐水中),然后装配成如图8—11所示的四套 装置中,每隔一段时间测量导管中水面的高度,结果如下表所示 (表中所列数据都为导管水面上升的高度/cm)

|
时间/小时 |
0 |
0.5 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
|
A瓶(盛干细铁丝) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
B瓶(盛沾了食盐水的细铁丝) |
0 |
0.4 |
1.2 |
3.4 |
5.6 |
7.6 |
9.8 |
|
C瓶(盛沾了清水的细铁丝) |
0 |
0 |
0 |
0.3 |
0.8 |
2.0 |
3.5 |
|
D瓶(细铁丝完全浸没在食盐水中) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
请回答下列问题:
(1)导管中水面为什么会上升?
(2)上述实验中,铁生锈的速率由大到小的顺序为(填小烧瓶的瓶号) 。
(3)影响铁生锈的因素有: 。
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值。注意阅读分析材料,据此完成下列要求。
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
(1)预测周期表中电负性最大的元素应为 (填元素符号);估计钙元素的电负性的取值范围: <X< 。
(2)简述元素电负性X的大小与元素金属性、非金属性之间的关系
。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 ;上表中最易形成离子键的两种元素的电负性之差为 。
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 520 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
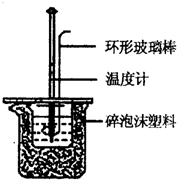 实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com