
题目列表(包括答案和解析)
用黄铁矿可以制取 H2SO4,再用 H2SO4 可以制取化肥(NH4)2SO4。煅烧含 FeS2 80.2% 的黄铁矿 75.0 t,最终生产出 79.2 t(NH4)2SO4。已知 NH3 的利用率为 92.6%,H2SO4 的利用率为 89.8%,试求黄铁矿制取 H2SO4 时的损失率。
硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸。
| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84.8% |
| SO3 | —— | 6.9% |
⑴SO2的催化氧化是硫酸工业的主要反应。现有标准状态下5.6 L SO2气体,在500℃、V2O5催化下转化成SO3,若SO2转化率为a%,放出热量为QkJ。该反应的热化学方程式为 ▲ 。
⑵已知在SO2催化氧化前后混合气体中各成分的体积分数如表,
则SO2的转化率为 ▲ 。
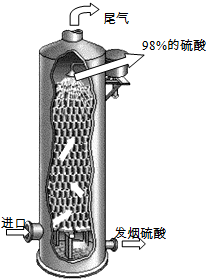
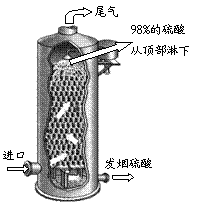 ⑶如右图所示,用98%的浓硫酸1.0t吸收SO3制得发烟硫酸(化学组成可表示为H2SO4·xSO3),可生产SO3质量分数为20%的发烟硫酸 ▲ t。
⑶如右图所示,用98%的浓硫酸1.0t吸收SO3制得发烟硫酸(化学组成可表示为H2SO4·xSO3),可生产SO3质量分数为20%的发烟硫酸 ▲ t。
⑷某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品充分灼烧,生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,再用0.02000 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL。
已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则样品中FeS2的质量分数是多少?(假设杂质不参加反应)
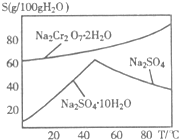 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
| ||
. |
| 温度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物质 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
 (2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.
(2011?泰州二模)硫酸在国民经济中占有极其重要的地位,我国常以黄铁矿(主要成分FeS2)为原料生产硫酸.| 成分 | 催化氧化前 | 催化氧化后 |
| O2 | 11% | 未测定 |
| SO2 | 7% | 未测定 |
| N2 | 82% | 84.8% |
| SO3 | -- | 6.9% |
| 800Q |
| a |
| 800Q |
| a |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com