
题目列表(包括答案和解析)
摩尔质量和气体摩尔体积
1.摩尔质量
单位物质的量的物质所具有的质量叫做摩尔质量(符号M).准确理解摩尔质量的概念,须注意以下几点:
(1)单位:SI中,摩尔质量的单位是kg·mol-1,中学阶段常用________,此外,还有kg·kmol-1,mg·mmol-1等,其中:1 g·mol-1=1 kg·kmol-1=1 mg·mmol-1.
(2)符号:摩尔质量的符号是M,如氧气的摩尔质量可表示为________.
(3)数值:当摩尔质量以g·mol-1为单位时:
M=Mr g·mol-1或M=Ar g·mol-1,
即它们的纯数值是相等的.
(4)由摩尔质量的概念,得到下列公式:n=![]()
2.气体摩尔体积
在一定的温度和压强下,单位物质的量气体所占的体积叫做气体摩尔体积(符号Vm).
标准状况下,气体的摩尔体积(Vm,0)约为22.4 L·mol-1.
注意:(1)气体摩尔体积不是“体积”,单位不是体积单位L、m3等,其常用单位为:L·mol-1,其SI单位为m3·mol-1.
(2)从气体摩尔体积的概念可抽象气体摩尔体积的公式.即Vm=![]() (或n=
(或n=![]() )
)
(3)概念中“单位物质的量”可以是1 mol,也可以是1 mmol或1 kmol等.
3.影响物质体积的因素
(1)物质所含粒子数的多少.物质所含粒子数________,________越大.
(2)物质所含粒子的________.
(3)物质内粒子间的________.
对固体和液体物质来说,(1)(2)起主要作用;对气体物质来说,(1)(3)起主要作用.
4.阿伏加德罗定律
在相同的温度和压强下,________,这个定律叫做阿伏加德罗定律.
准确理解阿伏加德罗定律要注意以下几点:
(1)使用范围:阿伏加德罗定律的使用范围是________物质,可以是单一气体,也可是混合气体.
(2)表述方式:阿伏加德罗定律的特征是“四同”——同温、同压、同体积、同分子数,其中三个量相同,第四个量必然相同.即阿伏加德罗定律可以有四种表述方式:
①当T、p、N(或n)相同时,V必相同.
②当T、p、V相同时,N(或n)必相同.
③当T、V、N(或n)相同时,p必相同.
④当p、N(或n)、V相同时,T必相同.
(14分)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时,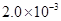 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下列问题:
(1)25℃时,HF电离平衡常数的数值Ka= 。
(2)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
(4)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH 7(填“>”、“<”或“=”);
将同温度下等浓度的四种盐溶液:?
| A.NH4Cl | B.NH4SCN? | C.CH3COONH4 | D.NH4HCO3 |
(14分)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=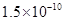
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:


请根据以下信息回答下列问题:
(1)25℃时,HF电离平衡常数的数值Ka= 。
(2)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
(4)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH 7(填“>”、“<”或“=”);
将同温度下等浓度的四种盐溶液:?
A.NH4Cl B.NH4SCN? C.CH3COONH4 D.NH4HCO3
按(NH4+)由大到小的顺序排列是: (填序号)。
按pH由大到小的顺序排列是: (填序号)
碳和硅属于同主族元素,在生活生产中有着广泛的用途。
(1)甲烷可用作燃料电池,将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,通入CH4的一极,其电极反应式是????????????????? ;
CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)? △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)? △H=-1160kJ·mol-1
则NO2被甲烷还原为N2的热化学方程式为_____________________________________
(2)已知H2CO3 HCO3-+ H+?? Ka1(H2CO3)=4.45×10-7
HCO3-+ H+?? Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+?????????????? Ka2(HCO3-)=5.61×10-11
CO32-+H+?????????????? Ka2(HCO3-)=5.61×10-11
HA H++A-????????????????? Ka(HA)=2.95×10-8
H++A-????????????????? Ka(HA)=2.95×10-8
请依据以上电离平衡常数,写出少量CO2通入到NaA溶液中的离子方程式
___________________________。
(3) 在T温度时,将1.0molCO2和3.0molH2充入2L密闭恒容器中,可发生反应的方程式为CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转???? 化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转???? 化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英(SiO2)与焦炭在高温的氮气流中反应生成,已知该反应的平衡常数表达式K=[c(CO)]6/[c(N2)]2,若已知CO生成速率为v(CO)=6mol·L-1·min-1,则N2消耗速率为v(N2)=??????????? ;该反应的化学方程式为________________________________________。
(18分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)==Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率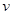 与时间t的关系如右图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
与时间t的关系如右图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。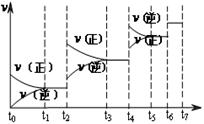
(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是 (提示:272 = 729)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com