
题目列表(包括答案和解析)
(12分)(1)已知离子反应: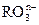 +6I—+6H+=R—+3I2+3H2O,n= ,R元素在
+6I—+6H+=R—+3I2+3H2O,n= ,R元素在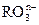 中的化合价是 。
中的化合价是 。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: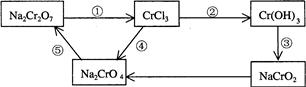
① 在上述有编号的步骤中,需用氧化剂的是 (填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是 。
(12分)(1)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n= ,R元素在
+6I—+6H+=R—+3I2+3H2O,n= ,R元素在 中的化合价是 。
中的化合价是 。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:

① 在上述有编号的步骤中,需用氧化剂的是 (填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是 。
(12分)(1)已知离子反应:![]() +6I—+6H+=R—+3I2+3H2O,n= ,R元素在
+6I—+6H+=R—+3I2+3H2O,n= ,R元素在![]() 中的化合价是 。
中的化合价是 。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
① 在上述有编号的步骤中,需用氧化剂的是 (填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+![]() (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是 。
(12分) (1)已知丙酮[ CH3COCH3 ]键线式可表示为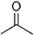 根据键线式回答下列问题:
根据键线式回答下列问题: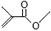 分子式: ,结构简式: 。
分子式: ,结构简式: 。
(2)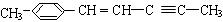 分子中最多有 个原子共直线;最多有 个原子共平面。
分子中最多有 个原子共直线;最多有 个原子共平面。
(3)写出乙烯分子的电子式: 。
(4)有机物(CH3)2CHCH(C2H5)CH=CH2的名称是 。
(5)写出甲苯制TNT化学方程式 。
(6) 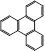 的一氯取代物有 种,
的一氯取代物有 种,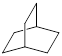 的二氯取代物有 种。
的二氯取代物有 种。
(每空2分,共12分)已知金属氧化物A和金属单质B在高温条件下反应生成C和D的同时放出大量的热;将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色液体。
(1)红褐色液体中H粒子的直径大小范围 。
(2)写出D、E的化学式:D 、E
(3)写出E的酸性溶液与双氧水反应的离子方程式 。
(4)写出F溶液中阳离子的检验方法: 离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com