
题目列表(包括答案和解析)

| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 | 熔点/K | 993 | 1539 | 183 |
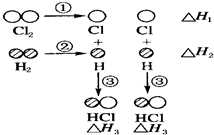 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/kJ?mol-1 | 436 | 243 | 431 |
A、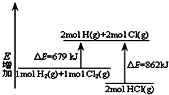 表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183 kJ?mol-1 | B、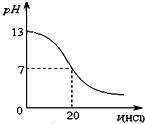 表示室温时用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1NaOH溶液,溶液pH随加入酸体积变化 | C、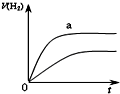 表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 | D、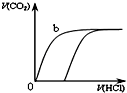 表示10 mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1mol/L HCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com