
题目列表(包括答案和解析)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol A、2mol B | 6mol A、4mol B | 2mol C |
| 到达平衡的时间(min) | 5 | 8 | |
| A的浓度(mol/L) | c1 | c2 | |
| C的体积分数 | w1 | w3 | |
| 混合气体密度(g/L) | ρ1 | ρ2 |
| A、若x<4,则2c1>c2 |
| B、若w3=w1,可断定x=4 |
| C、无论x的值是多少,均有2ρ1=ρ2 |
| D、容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol?L-1?min-1 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol A、2mol B | 6mol A、4mol B | 2mol C |
| 到达平衡的时间(min) | 5 | 8 | |
| A的浓度(mol/L) | c1 | c2 | |
| C的体积分数 | w1 | w3 | |
| 混合气体密度(g/L) | ρ1 | ρ2 |
| A、若x<4,则2c1<c2 |
| B、若w3=w1,可断定x=4 |
| C、无论x的值是多少,均有2ρ1=ρ2 |
| D、容器甲中反应从开始到达平衡平均速率为v(A)=0.3 mol?L-1?min-1 |


| 实验内容 | 实验现象 | |
| A | 收集一集气瓶气体,观察颜色,然后向瓶内倒入约占瓶容积1/5的蒸馏水,充分振荡. | 蒸馏水呈浅黄绿色,瓶内气体仍呈黄绿色. |
| B | 取出瓶内部分溶液,滴入紫色石蕊试液中直至过量. | 紫色石蕊试液先变红色,后红色褪色. |
| C | 取出瓶内剩下的部分溶液,滴入硝酸银溶液中. | 产生大量白色沉淀 |
| D | 最后向瓶内倒入少量浓氢氧化钠溶液,振荡. | 瓶内黄绿色气体立即消失. |
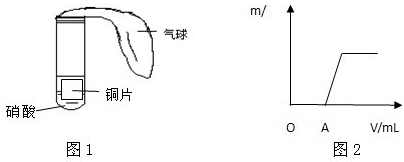
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如下图所示,回答下列问题:
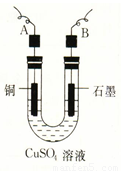
(1)该装置中B电极为电解池的 极(填“阴”或“阳”);
(2)A电极上的电极反应式为 ;
电解池总反应的离子方程式为 ;
(3)电解过程中,电解质溶液的酸性 (填“增强”、“减弱”或“不变”);
(4)下列实验操作中必要的是 (填写字母);
(A)称量电解前的电极的质量;
(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;
(C)刮下电解后电极上析出的铜,并清洗,称量;
(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为 (用带有m、V的计算式表示)。
1.B 2.D 3.D 4.B 5.C 6.AB 7.BD
8.9.略
10.(1)2 2 4 1 1:1
(3)5 2 14 5 2 7
11.(1)0.06 440 (2)400 (3)1/2≤a<1
12.(1)10.7% (2)0.25 (3)3:2
13.Fe5O7
14.(1)
15.40mL或120mL
16.(1)
编 号
①
②
③
④
A物质的组成
NaOH、Na2CO3
Na2CO3
Na2CO3、NaHCO3
NaHCO3
(2)Na2CO
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com