
题目列表(包括答案和解析)
(14分)I、通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌等金属和少量矿物杂质(与酸不反应)。制作电器及其他仪器产品时必须要求是纯铜,为此以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯。
表:几种物质形成沉淀时的pH
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 7.6 | 2.7 | 5.7 | 4.7 |
完全沉淀时的pH | 9.7 | 3.7 | 8.5 | 7.3 |
(1)在精炼铜时,阴极电极反应方程式为 ;金、银以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底。
|
①试剂a最好选用 (填写序号),加入试剂a的目的是 。
a、氯水 b、高锰酸钾溶液 c、硝酸 d、双氧水
②操作①是 ,根据上表数据分析,除杂方案中能够除去的杂质金属阳离子是 (填化学式)。
II、重金属离子对河流海洋等会造成严重的污染。某化工厂产生的废水(pH=2.0,密度为1g?mL-1)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01mol?L-1,排放前拟用沉淀法回收这两种金属,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入 (填字母序号)沉淀的效果最好
a、NaOH b、Na2S c、KI d、Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
(14分)(Ⅰ)气体制备时须先检查装置的气密性,下列各图所示装置,肯定不符合气密性检查要求的是 。
(Ⅱ)下面是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.分液漏斗 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填编号)。
(2)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
(3)使用前要检查仪器是否漏液的是 (填编号)。
(Ⅲ)实验室需要95 mL 1.0 mol·L-1稀硫酸,现用98%的浓硫酸(其密度为1.84 g/mL)来进行配制。若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.250 mL容量瓶
E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
A.将稀释的硫酸液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.未冷却至室温就定容。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
E.容量瓶使用时未干燥
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(14分)(Ⅰ)气体制备时须先检查装置的气密性,下列各图所示装置,肯定不符合气密性检查要求的是 。

(Ⅱ)下面是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.分液漏斗 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填编号)。
(2)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
(3)使用前要检查仪器是否漏液的是 (填编号)。
(Ⅲ)实验室需要95 mL 1.0 mol·L-1稀硫酸,现用98%的浓硫酸(其密度为1.84 g/mL)来进行配制。若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.250 mL容量瓶
E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
A.将稀释的硫酸液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.未冷却至室温就定容。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
E.容量瓶使用时未干燥
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。
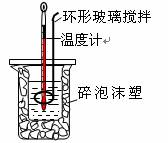
(1)在该实验中,量取50 mL 盐酸或NaOH 溶液,需要用到的玻璃仪器是___________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
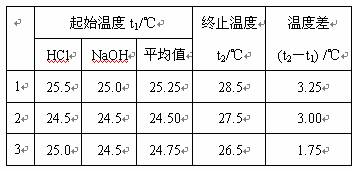
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指__________________温度。
(4)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g?℃) ,稀溶液的密度都为1g/cm3)。
(5) 如果用50 mL 0.55mol/L的氨水(NH3?H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是
________________________ 。
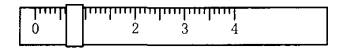
相对分子质量为204.0)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol•L-1左右,滴定终点时溶液的pH约为9.1。该生用托盘天平称量邻苯二甲酸氢钾时,在左盘放有一个1g砝码,游码位置如图所示:
(1)将称好的邻苯二甲酸氢钾放于锥形瓶中,加适量水溶解,溶液无色,再加入指示剂________(从甲基橙、酚酞、石蕊中选择)1~2滴,用NaOH溶液滴定至终点,现象是________。
(2)该生进行三次实验,所取固体质量均相同,填写下表:
实验编号 邻苯二甲酸氢钾质
量/g 待测NaOH溶液体
积/mL
1 18.20
2 17.10
3 16.90
(3)滴定中误差较大的是第________次实验,造成这种误差的可能原因是(只填三种即可):a________b________c________
(4)NaOH溶液的物质的量浓度为(只列出计算式,不必求出结果)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com