I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是
AB
AB
(填序号).
A.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
B.制备氢氧化铁胶体时,应向沸水中逐滴滴加1~2mL饱和的FeC1
3溶液,并继续加 热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较
D.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
E.除去蛋白质溶液中混有的NaC1,可以先加入AgNO
3溶液,然后过滤
F.在进行反应热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好反应、进行两到三次实验,取平均值
II.石灰石的主要成分是碳酸钙,含氧化钙约40~50%,较好的石灰石含CaO约45~53%.此外还有SiO
2、Fe
2O
3、Al
2O
3及MgO等杂质.测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC
2O
4?H
2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量.涉及的化学反应为:H
2C
2O
4+MnO
4-+H
+→Mn
2++CO
2↑+H
2O(未配平).CaC
2O
4 沉淀颗粒细小,易沾污,难于过滤.为了得到纯净而粗大的结晶,通常在含Ca
2+的酸性溶液中加入饱和 (NH
4)
2C
2O
4,由于C
2O
42-浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中C
2O
42-浓度慢慢增大,可以获得颗粒比较粗大的CaC
2O
4沉淀.沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使CaC
2O
4溶解度太大.根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
SiO2
SiO2
(2)沉淀 CaC
2O
4要加入沉淀剂饱和的 (NH
4)
2C
2O
4 溶液,为什么?
保持较大的C2O42-离子浓度,使Ca2+沉淀完全
保持较大的C2O42-离子浓度,使Ca2+沉淀完全
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差
降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差
(4)若开始用去m g样品,最后滴定用去浓度为c mol/L 的KMnO
4 溶液V mL,推出CaO含量与 KMnO
4的定量计算关系.ω%=
.

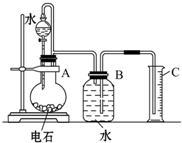 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数. 2NH3(g)。实验室模拟化工生产,控制起始浓度均为
2NH3(g)。实验室模拟化工生产,控制起始浓度均为
