
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是
C
C
.
A.C(s)+H
2O(g)=CO(g)+H
2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H
2O(l)△H<0
C.2H
2(g)+O
2(g)=2H
2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应的电极反应式为
H2+2OH--2e-=2H2O
H2+2OH--2e-=2H2O
.
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与如图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:①若X和Y均为惰性电极,a为CuSO
4溶液,则阳极的电极反应式为
4OH--4e-=H2O+O2↑
4OH--4e-=H2O+O2↑
,电解时的化学反应方程式为
2CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
42CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
4,通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为
0.4
0.4
mol.②若X、Y依次为铜和铁,a仍为CuSO
4溶液,且反应过程中未生成Fe
3+,则Y极的电极反应式为
Fe-2e-=Fe2+
Fe-2e-=Fe2+
③若用此装置电解精炼铜,
粗铜
粗铜
做阳极,电解液CuSO
4的浓度
减小
减小
(填“增大”、“减小”或“不变”).
④若用此装置在铁制品上镀铜,铁制品做
阴极
阴极
,电镀液的浓度
不变
不变
(填“增大”、“减小”或“不变”).


 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理上可以设计成原电池的是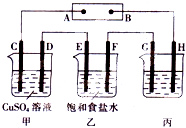 某研究性学习小组将下列装置按如图所示连接,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
某研究性学习小组将下列装置按如图所示连接,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题: 如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞液,在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞液,在F极附近显红色.试回答以下问题: 有如图装置:回答下列问题:
有如图装置:回答下列问题: