按要求书写热化学方程式(是离子反应的也可用离子方程式表示).
(1)表示强酸和强碱中和热的热化学方程式:
H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1
H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1
.
(2)火箭推进器常以气态联氨(N
2H
4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环.测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式:
N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-644kJ?mol-1
N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-644kJ?mol-1
.
(3)由氢气和氧气反应生成1mol水蒸气.放热241.8kJ.写出该反应的热化学方程式:
H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ?mol-1或2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ?mol-1或2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
.若1g水蒸气转化成液态水放热2.5kJ,则反应H
2(g)+
O
2(g)=H
2O(l)的△H=
-286.8
-286.8
kJ?mol
-1,H
2的燃烧热为
286.8
286.8
kJ?mol
-1(4)已知A、B两种气体在一定条件下可发生反应:2A+B═C+3D+4E.现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成.在相同温度下测得反应前后压强分别为6.06×10
5Pa和1.01×10
6Pa,又测得反应共放出QkJ热量.试根据上述实验数据写出该反应的热化学方程式
2A(g)+B(g)═C(g)+3D(l)+4E(g)△H=-
kJ/mol
2A(g)+B(g)═C(g)+3D(l)+4E(g)△H=-
kJ/mol
.

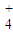
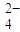

 O2 (g)=H2O;△H=-241.81kJ?mol-1
O2 (g)=H2O;△H=-241.81kJ?mol-1 O2 (g)=CO (g);△H=-110.51kJ?mol-1
O2 (g)=CO (g);△H=-110.51kJ?mol-1