
题目列表(包括答案和解析)
(8分)(2011·泰州模拟)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 | 时间 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(8分)(2011·泰州模拟)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
|
实验 序号 |
时间 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800 |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800 |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800 |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820 |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10 min~20 min时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1,且c3________1.0 mol/L(填“=”、“>”或“<”)
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________。
某化学反应2A(g) B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 |   时间 时间浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(8分)(2011·泰州模拟)某化学反应2AB+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验 序号 | 时间 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10 min~20 min时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1,且c3________1.0mol/L(填“=”、“>”或“<”)
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________。
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
CO (g) +H2 (g) △H= +131.3 kJ?mol-1(······①
(1)实际工业生产中,向炭层间隔交替通入水蒸气和空气,其中通入空气的原因是由于该反应是吸热,导致炭层温度降低,须及时通入富氧空气促进炭层的燃烧放热:
C (s) + O2(g)= CO2 (g);△H = -393.5kJ·mo1-1 ······②
为保持生产的连续性,若不考虑其它热量的产生和损耗,则每间隔应通入的水蒸气和空气的体积比(同温同压)约为多少?(设空气中氧气的体积占1/5)
(2)一定温度下,三个容器中均进行着上述反应①,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。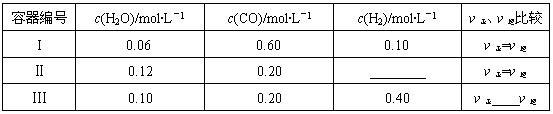
(3)生物乙醇可由淀粉或纤维素等生物质原料发酵获得。利用乙醇可进而获得合成气(CO、H2)。用乙醇生产合成气有如下两条路线:
a、水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b、部分催化氧化:CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)
某生物质能研究所准备利用乙醇得到的合成气合成一种生物汽油。乙醇各分一半按a、b两式反应。合成气合成生物汽油的反应为:2mCO+(2m+n)H2→2CmHn+2mH2O。假定合成的生物汽油中含有X、Y两种成分,且X、Y都是有8个碳原子的烃,X是苯的同系物,Y是烷烃。
①X的分子式为 ,Y的分子式为 。
②50吨质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),则最终可获得X的质量为多少吨?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com