
题目列表(包括答案和解析)
(1)P4(白磷,s)+5O2(g)══ P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)══ 1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ,
相同状况下,红磷的稳定性比白磷 (填“强”、“弱”或“无法判断”)
(2)在原电池中,通常较活泼的金属做 极,发生 反应;
电解池中,与电源正极相连的极是 极,发生 反应。
(3)右图所示水槽中试管内有一枚铁钉,放置数天后观察: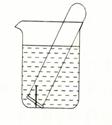
①若试管内液面上升,发生 腐蚀,正极反应式为 。
②若试管内液面下降,发生 腐蚀,正极反应式为 。
(2分)白磷(P4)是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键再结合一个氧原子。化学反应可视为旧键断裂和新键形成的过程。现提供以下化学键的键能(kJ/mol)。P-P键:198 kJ /mol ;P-O键:360 kJ /mol ;O=O键:498 kJ /mol ;P=O键:585 kJ /mol。试根据这些数据,计算出以下反应的反应热:P4(S,白磷)+ 5O2(g)= P4O10(s);
ΔH= 。
(1)P4(白磷,s)+5O2(g)══ P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)══ 1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ,
相同状况下,红磷的稳定性比白磷 (填“强”、“弱”或“无法判断”)
(2)在原电池中,通常较活泼的金属做 极,发生 反应;
电解池中,与电源正极相连的极是 极,发生 反应。
(3)右图所示水槽中试管内有一枚铁钉,放置数天后观察:
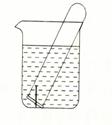
①若试管内液面上升,发生 腐蚀,正极反应式为 。
②若试管内液面下降,发生 腐蚀,正极反应式为 。
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4(s,白磷)+5O2(g)=P4O10(s)ΔH1=-2 983.2 kJ·mol-1;P(s,红磷)+ O2(g)=
O2(g)=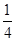 P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
P4O10(s)ΔH2=-738.5 kJ·mol-1,则该温度下白磷转化为红磷的热化学方程式为________________。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s)ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。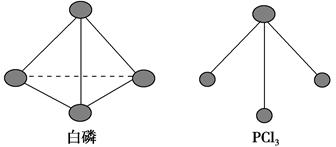
则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH=________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com