
题目列表(包括答案和解析)
探究铁及其化合物的氧化性和还原性
1.铁的存在形态:(1)游离态:如陨铁.(2)化合态:+2价铁和+3价铁.
2.铁的氢氧化物
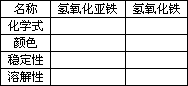
3.“铁”的五颜六色
(1)银白色:块状铁;白色:Fe(OH)2.
(2)黑色:FeO、Fe3O4、FeS.
(3)红棕色:Fe2O3;红褐色:Fe(OH)3;红色:[Fe(SCN)]2+.
(4)浅绿色:Fe2+,[Fe(SCN)]+.
(5)棕黄色:Fe3+;黄色:FeS2.
(6)灰黑色:粉状铁.
4.铁及其化合物的氧化性和还原性
(1)FeCl3的氧化性实验

(2)Fe的还原性实验

(3)FeCl2的氧化性、还原性实验

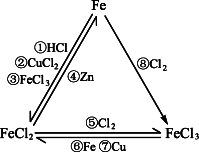
结论1:金属铁只有还原性;通常认为氯化铁只有氧化性;氯化亚铁既有氧化性,又有还原性.
结论2:金属铁、氯化铁、氯化亚铁之间的相互转化——铁三角:
| [CO] | [CO2] |

| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
(16分)金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应:
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为 ;
②达平衡后,若温度升高,的值增大,则Q 0(填“>”、“=”、“<”)。
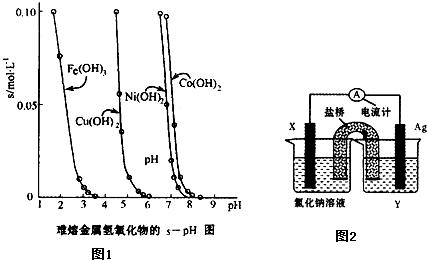
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为 (填序号)。 
A.小于l B.4左右 C.大于6 D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)= : : 。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
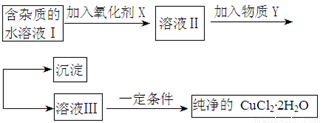
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
|
|
Fe3+ |
Fe2+ |
Cu2+ |
|
氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
|
氢氧化物沉淀完全时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)加入氧化剂的目的是
(2)下列最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是
(4)如果不用物质Y而直接用可溶性碱溶液能不能达到目的? (填“能”或者“不能”)。若不能,试解释原因 (若填“能”,此空不用回答)
(5)最后能不能直接蒸发得到CuCl2·2H2O? (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O (若填“能”,此空不用回答)
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 ,试解释原因
(8)FeCl3溶液具有净水作用的原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com