
题目列表(包括答案和解析)
(1)液氨类似于水的电离,试写出液氨的电离方程式;
(2)下列离子方程式书写正确的是________
A.石灰乳与Na2CO3溶液混合:Ca2++CO32- CaCO3↓
CaCO3↓
B.NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-NH3↑+SO32- +2H2O?
+2H2O?
C.酸性条件下KIO3溶液与KI溶液反应生成I2:IO32-+5I-+3H2O3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3·H2O AgOH↓+NH4+
AgOH↓+NH4+
E.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42- BaSO4↓+H2O?
BaSO4↓+H2O?
F.CuSO4
溶液吸收H2S气体:Cu2++H2S CuS↓+2H+?
CuS↓+2H+?
G.AlCl3
溶液中加入过量的浓氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
H.
等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3- BaCO3↓+NH3·H2O+H2O
BaCO3↓+NH3·H2O+H2O
I.LiAlH4
溶于适量水后得到无色溶液,则化学方程式可表示为:LiAlH4+2H2O LiAlO2+4H2↑
LiAlO2+4H2↑
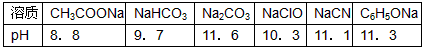
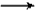 NaHCO3+C6H5OH
NaHCO3+C6H5OH 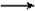 Na2CO3+2C6H5OH
Na2CO3+2C6H5OH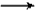 NaHCO3+C6H5ONa
NaHCO3+C6H5ONa 复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2HClO
B.CO2+H2O +NaClO = NaHCO3+HClO
C.CO2 +H2O +C6H5ONa![]() NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa![]() Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值为_______(填数值);pH最大的是 (填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
请根据上述反应,总结出复分解反应发生的另一规律:
。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,反应的离子方程式为 。
为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置。回答下列问题:

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是 。
按照乙同学的观点,该装置需作的改进是: 。
(3)假设Na2O2 完全反应,反应后B装置中固体生成物可能是:
① Na2SO3; ② Na2SO4; ③ Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl, 1mol·L-1HNO3, 1 mol·L-1 BaCl2, 1 mol·L-1 Ba(NO3)2,
0.01mol·L-1KMnO4酸性溶液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中。 |
固体完全溶解 |
|
步骤2:往Ⅰ试管中加入 ,再滴加 。 |
,则证明生成 物中含Na2SO4。 |
|
步骤3:往Ⅱ试管中 。 |
若 , 则说明生成物中有Na2SO3;若 , 则说明生成物中没有Na2SO3。 |
(4)生成物中亚硫酸钠含量的测定:①取a克生成物配制成100ml溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.0100mol·L-1碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
②计算:生成物中亚硫酸钠的质量分数为 。(Na2SO3的式量为126)
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题: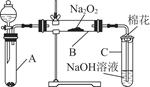
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出反应的化学方程式 。
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是 。按照乙同学的观点,该装置需做的改进是
。
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2 mol·L-1 HCl溶液,1 mol·L-1 HNO3溶液,1 mol·L-1 BaCl溶液,1 mol·L-1 Ba(NO3)2溶液,0.01 mol·L-1 KMnO4酸性溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 ,再滴加 | , |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中 | |
| | 若 , |
| 则证明生成物中有Na2SO3;若 | |
| | |
| 则说明生成物中没有Na2SO3。 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com