
题目列表(包括答案和解析)
CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:

(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为?????? ;
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是?????? ,吹入空气的作用为??? ??? 。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的??? ??? (填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为??? ??? 。
(5)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品。检验粗产品洗涤干净的实验操作和现象是???????? 。
(6)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Co2+ | 6.9 | 9.4 |
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
②???????? 。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④???????? 。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。
CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下: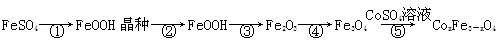
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为 ;
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是 ,吹入空气的作用为 。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的 (填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为 。
(5)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品。检验粗产品洗涤干净的实验操作和现象是 。
(6)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
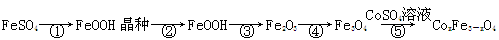
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
新型材料纳米α-
Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等.在不同温度下,α-Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.(1)
甲同学用下图所示装置进行α-Fe粉与水蒸气的反应.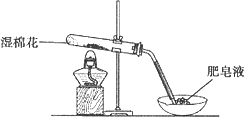
证明实验中有氢气产生的现象是
________.(2)
乙同学用下图所示装置进行α-Fe粉与水蒸气的反应并验证产物.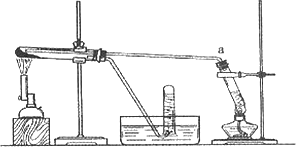
①试管
a中的物质是________.②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:

实验现象不能确定是否存在
Fe3O4,主要原因是________(用离子方程式表示)③乙同学称取
5.60 g Fe粉,用上图装置反应一段时候后,停止加热.将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分.若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为________mol.向Fe3O4和 Fe的固体混合物6.88 g中加入50 ml 2 mol·L-1 H2SO4,恰好使固体完全溶解,并放出一定量气体.在所得溶液中加入KSCN溶液,溶液不变红色.
(1)写出Fe3O4和稀H2SO4反应的化学方程式________.
(2)混合物中Fe3O4和Fe的物质的量(写出计算过程).
(3)求反应中产生的气体在标准状况下的体积.(写出计算过程).
(4)若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量.(写出计算过程).
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
C
A
C
A
B
A
D
D
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
A
C
B
D
二、填空题:(17题每空3分,第19(2)题3分,其它每空2分,共29分)
17.(CH3)C-CH=CH2 ;(CH3)
18.(1)C25H20 (2) 不 (3)3
.files/image021.gif)
.files/image022.gif) 19.(1)结构简式为 CH3
CH3
19.(1)结构简式为 CH3
CH3
Br ,
CH3
.files/image023.gif) |
CH3
(2)33
20.(1)C6H4S4 5?
(2)n+1-.files/image025.gif) (3)C8H8
(3)C8H8 .files/image026.gif)
三、实验题:( 第一小题3分,其它每小题2分,共13分)
21. (1)写出实验室制取硝基苯化学方程式:
。
(2)催化剂;脱水剂
(3)控制水溶液温度为
(4)试管受热均匀,便于控制温度 (5)使苯蒸气冷凝回流,减少挥发
(6)倒入水中,使用分液漏斗分离下层硝基苯.
四、推断题:( 每空2分,共10分)
五、计算题:(第(1)(2)小题各3分,第(3)小题4分,共10分)
(1)根据.files/image031.gif) →
→.files/image033.gif) 可知,1mol
可知,1mol .files/image031.gif) 生成5mol水,即
生成5mol水,即
(2)反应后和反应前的压强之比即为气体的物质的量之比,设反应消耗氧气的物质的量
为y,则.files/image035.gif) =0.557,y=6.18mol。
=0.557,y=6.18mol。
(3)燃烧后气体物质的量减少:(1+6.18―4)mol=3.18mol,设生成.files/image037.gif) 的丁烷为amol,
的丁烷为amol,
生成CO的丁烷为(1-a)mol,则有:
.files/image031.gif) +
+.files/image039.gif) →
→.files/image041.gif) +
+.files/image033.gif) n
n
1 6.5 4 3.5
a
.files/image043.gif) →4CO+
→4CO+.files/image033.gif) n
n
1 4.5 4 1.5
1-a 1.5(1-a)
由题意:
即丁烷有84%转化为.files/image037.gif) ,16%转化为CO,它们的物质的量分别为:
,16%转化为CO,它们的物质的量分别为:
n(.files/image037.gif) )=4mol×84%=3.36mol n(CO)=4mol×16%=0.64mol
)=4mol×84%=3.36mol n(CO)=4mol×16%=0.64mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com