
题目列表(包括答案和解析)
(10分)已知醛在一定条件下可以发生如下转化:
![]()
![]()

![]()
![]()
 物质C是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中有机物的转化关系回答下列问题:
物质C是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中有机物的转化关系回答下列问题:
![]() (1)写出指定物质的结构简式:A ,
(1)写出指定物质的结构简式:A ,
![]() G 。
G 。
![]() (2)反应①的反应类型是 ,反应②的反应类型是 ,
(2)反应①的反应类型是 ,反应②的反应类型是 ,
![]() 反应⑧的反应类型是 。
反应⑧的反应类型是 。
![]() (3)写出C与新制Cu(OH)2共热生成D的化学方程式(有机物写结构简式):
(3)写出C与新制Cu(OH)2共热生成D的化学方程式(有机物写结构简式):
![]() 。
。
![]() 写出反应⑧的化学方程式(有机物写结构简式):
写出反应⑧的化学方程式(有机物写结构简式):
![]() 。
。
![]() (4)H有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的H的同分异构体结构简式为:
(4)H有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的H的同分异构体结构简式为:
![]() 。
。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素位于周期表中第 周期,第 族。.
(2)B与氢氧化钠溶液反应的化学方程式为:
。
(1) G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为
,当生成2![]() 二氧化氯时,转移电子
二氧化氯时,转移电子 ![]() 。
。
(2) 溶液F在空气中长期放置生成H的化学反应方程式为:
。
(3) H的溶液与稀硫酸反应产生的现象为
。
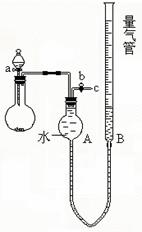
某校课外实验小组同学设计下图装置进行实验。(夹持装置已略去)。
(1)该小组同学用上图装置进行“乙炔的制取及燃烧性质验证”实验。
①制取乙炔的化学方程式是 。
②点燃乙炔前,需要验纯。简述检验可燃气体纯度的操作方法:
。
③在导管口c处点燃乙炔,观察到的现象是
;
(2)该小组同学用上图装置进行实验,确定某饱和醇的结构。
①反应前,先对量气管进行第一次读数。反应后,待装置温度冷
却到室温,再对量气管进行第二次读数。读数时,应注意的操作
是
,并使视线与凹液面最低处相平。
②实验数据记录如下:(表中读数已折合成标准状况下的数值)
| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62 g | 5 .0g(足量) | 40 mL | 264 mL |
| ② | 0.31 g | 2.5 g(足量) | 40 mL | 152mL |
已知该饱和醇的相对分子质量为62。根据上述数据可确定该饱和醇是 _____元醇。
(16分)Ⅰ铝粉与某些金属氧化物组成的混合物叫铝热 剂,铝热剂在高温下发生的反应叫铝热反应。如:2Al+
剂,铝热剂在高温下发生的反应叫铝热反应。如:2Al+ Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上
Fe2O32Fe+Al2O3,反应发生时放出大量的热。仔细阅读上 述信息回答下列问题:
述信息回答下列问题:
(1)“铝热反应”属于四种基本反应类型中的________________反应。
(2)信息中的“某些”指__(填“比铝活泼的”“比铝不活泼的”或“任意”)。
(3)试写出铝粉与MnO2发生的铝热反应方程式
_____________________________________________________________。
(4)题给的铝热反应可用于野外焊接钢轨,试解释其基本原理________________________________________________________________。
II铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途。
(5)铝制容器不能盛装NaOH溶液的原因(用离子方程式表示)
; (6)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
(6)胃舒平是治疗胃酸(HCl)过多的常用药物,其中含有的有效成分是氢氧化铝,其治疗原理是(用离子方程式表示): ;
碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式:
;
(7)为完全沉淀氯化铝溶液中的铝元素,常加入过量的 ,反应的化学方程式: 。
已知:在室温时H2O H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++
CH3COO- Ka=1.8×10-5
H++
CH3COO- Ka=1.8×10-5
(1)取适量醋酸溶液,加入少量醋酸钠固体,此时溶液中C(H+)与C(CH3COOH)的比值 (填“增大”或“减小”或“不变”)
(2)醋酸钠水解的离子方程式为 。当升高温度时,C(OH—)将 (填“增大”“减小”“不变”);
(3)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(4)将等体积等浓度的醋酸和氢氧化钠溶液混合后,所得溶液中离子浓度由大到小的顺序是 。
(5)若醋酸和氢氧化钠溶液混合后pH<7,则c(Na+)_______________ c(CH3COO-)(填“大于”、“小于”或“等于”),
(6)室温时,若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2 mL混合,则下列说法不正确的是____________。
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固
体醋酸钠后测得溶液的C(OH-)为2.2×10-5mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14)
(8)取10mL0.5mol·L-1盐酸溶液,加水稀释到500mL,则该溶液中由水电离出的c(H+)
= mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com