
题目列表(包括答案和解析)
| A | B | C | D | E | |
| n(CO2) | 3 | l | 0 | 1 | l |
| n(H2) | 2 | l | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | l |
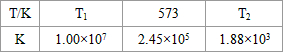
| T/°C | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 2 |
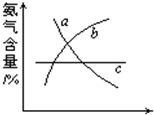
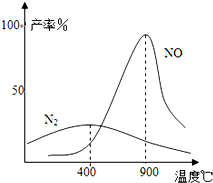
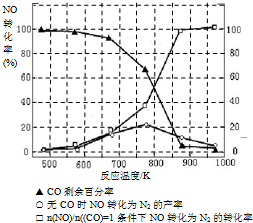
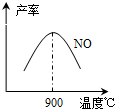 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
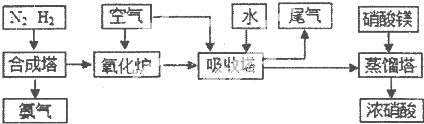
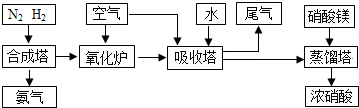
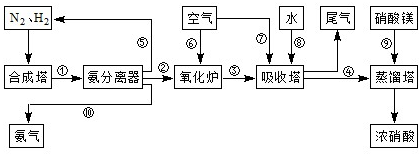
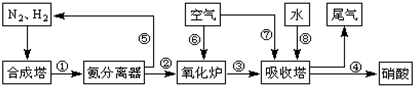
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因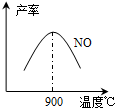 工业合成氨与制备硝酸一般可连续生产,流程如下:
工业合成氨与制备硝酸一般可连续生产,流程如下: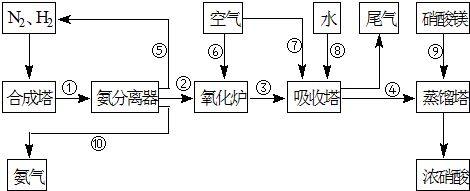
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| n(NO) |
| n(CO) |
一、选择题(本题包括9小题,每小题3分,共27分,每小题只有一个选项符合题意)
1. B 2.A 3.C 4.B 5.B 6.D 7.B 8.D 9. C
二、选择题(本题9小题,每小题4分,共36分。每小题有一个或两个选项符合题意)
10.AD 11.C 12.BC 13.D 14.AC 15.AD 16.A D 17.C 18.D
三、本题包括3小题,共34分)
19.(11分)NaCl+NH3+CO2+H2O = NaHCO3↓+NH4Cl(1分)
(1) 漏斗中与试管中的液面差保持不再变化或漏斗中的液面不再下降(2分)
(2) a, 氯化氢或HCl; 否 (3分)
(3) NH3; CO2; ①; (3分)
(4) 过滤 2NaHCO3 =Na2CO3+H2O+CO2↑ (2分)
20 . (11分)
Ⅰ. (1)酚酞(1分) 1~2滴(1分);
(2)①用干净的玻璃棒蘸取待测液滴到pH试纸上,半分钟后,将试纸的颜色与标准比色卡对照,读出溶液的pH即可。(2分) ② C(1分)
(3)乙同学。(1分)
甲同学的实验不能充分说明盐酸的氢氧化钠发生了反应,有可能是盐酸和红色物质反应生成了无色物质。乙同学的实验,随着滴加盐酸,溶液的pH由大于7逐渐减少到7,这充分证明溶液中的氢氧化钠因反应而消耗了;(2分)
Ⅱ. (4)29.2%;(2分) (5)盐酸具有挥发性。(1分)
21. (12分)
(1)铜锌及浓盐酸一起组成了原电池,加快了反应速率 (2分)
(2)① 否(1分); 因为H2本身难溶于水 (1分);
②
验证方法
预测现象及结论
将铜片加入稀硫酸中,并微热(1分)
若无气体放出,则不含锌等活泼金属杂质;
若有气体则有锌等杂质(1分)
(3)(任选一种方法即可)
验证方法
预测现象及结论
向白色沉淀中加入稀HNO3等强氧化剂(1分)
溶液变蓝色,说明是一价铜(1分)
向氯化亚铜悬浊液中加入氯化钾溶液(1分)
如白色沉淀消失且得无色溶液,则原溶液为氯化亚铜,否则不是(1分)
(4).files/image064.gif) (2分);
(2分);
加水稀释后,.files/image066.gif) <K,平衡向生成CuCl(s)的方向移动 (2分)
<K,平衡向生成CuCl(s)的方向移动 (2分)
四、(本题包括3小题,共34分)
22. (10分) (1).files/image068.gif)
(2)II因为滤液A是偏铝酸钠和氢氧化钠溶液,按途径I直接向A中加入盐酸得到的AlCl3溶液中含有大量的氯化钠杂质;按途径II通入二氧化碳气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液。所以途径II合理。
(3)蒸发浓缩、冷却结晶
(4).files/image070.gif)
或.files/image072.gif)
(5)不合理 因为该方案操作步骤多、时间长,消耗试剂量大
(除(4)、(5)中第一个空每空1分以外,其余每空2分)
23、(共11分)
(1)BaSO4(s)+
(2)S2- + H2O .files/image073.jpg) HS- + OH-(2分)
HS- + OH-(2分)
(3)计算过程 :设每次用
BaSO4+CO32-=BaCO3+SO42-
(2.0-x) mol•L-1 x mol•L-1
.files/image075.gif) == 0.042 (2分)
== 0.042 (2分)
X = 0.081(0.084也给分) (1分);
处理次数 = 0.2mol/0.081mol=2.5(1分)(2.38也给分)。
答:至少处理3次 (1分)
(4)节能,环保 (各1分,共2分。合理答案就可得分)
24.(共13分)
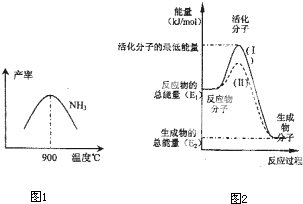
(1)0.15(2分) 2(1-1/a) (3分) (2)N2+6e-+6H+=2NH3 (2分)
(3)N2 (1分) 生成NO的反应为放热反应,升高温度转化率下降 (2分)
进一步与NO反应生成硝酸(1分)
(4) NO+NO2+H2O=2HNO2;(1分) CO (NH2)2+2HNO2=CO2+2N2+3H2O(1分)
五、(本题包括1小题,9分)
25.(9分)
(1)羧基、羟基(2分)
(2).files/image077.jpg) (2分)
(2分)
(3)消去反应;NaOH(或Na2CO3等其它合理答案)(2分)
(4)1、4
(5) .files/image079.jpg)
.files/image081.jpg)
.files/image083.jpg)
.files/image085.jpg) (1分)
(1分)
六、选择题(本题包括2小题,每小题10分)
26. (10分)
(1)醛比酮容易发生该反应;
苯基酮极难发生该反应;
羰基所连的碳上氢原子越少或取代基越多或取代基的碳原子数越多,越难反应;
取代基为两个乙基时,难以发生该反应。 (各1分,任写三条)
(2) HCl、NaOH(或Na2CO3、Cl2能降低NaHSO3浓度的试剂 )(2分)
(3)①(CH3)2CHCOCH3 + 3Cl2 + 3NaOH → (CH3)2CHCOCCl3 + 3NaCl + 3H2O(2分)
②(CH3)2CHCOONa(1分)
(4) 氧化还原反应 (氧化反应、还原反应、歧化反应 )(1分)
萃取(或蒸馏)(1分)
27. (1)MgO>CaO>NaCl>KCl (2分)
(2) ①1s22s22p63s23p63d104s1或[Ar] 3d104s1 (1分) C(1分)
② 水的熔、沸点较高,结冰时密度减小(2分)
③正四面体(2分)
(3)B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com