
题目列表(包括答案和解析)
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴(3分)随着工业化、城镇化的快速发展,我们所生存的环境也面临越来越严峻的污染问题,如酸雨的形成、汽车尾气污染、工业废气污染、大量生活垃圾的产生等。
①下列措施不能够改善环境质量的是 (填字母)。
a.对所有垃圾通过露天焚烧的方式进行处理
b.给汽车排气管加装尾气催化净化装置以减少尾气污染
c.在煤炭中添加生石灰以减少酸雨的发生
②城市空气质量监测中,不需要监测的指标的是 (填字母)。
a.SO2浓度 b.NOx浓度 c.可吸入颗粒物的含量 d.CO2浓度
③现代人已经进入以“室内污染”为标志的第三个污染阶段,以下不属于室内污染物的是
(填字母)。
a.烹饪时产生的油烟 b.石材缓慢释放的放射性气体
c.各种板材中粘合剂释放的甲醛等 d.天然气燃烧产生的CO2和水
⑵(6分)化学与新材料开发密切关联,化学是人类进步的关键。

①近日,《中国航空报》透露了一条重大消息,中国在先进高温合金领域不断获得重大成果。可以说,没有高温合金,就没有今天先进的航空发动机。下列物质中不属于合金的是 (填字母)。
a.硬铝 b.玻璃钢 c.不锈钢 d.黄铜
②新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于 (填“合成纤维”、“合成橡胶”或“塑料”)材料。环保型聚乙烯塑料袋可以用于食品包装,合成该聚合物的反应可表示为 。
③随着电解工业的发展,铝制品已经被人类广泛使用,但是常温下不可以用铝制容器盛装的是 (填字母)。
a.浓氢氧化钠溶液 b.浓硫酸 c.浓硝酸 d.啤酒
在室外,不能将铜质电线和铝质电线直接相连接,否则会因发生 腐蚀而形成安全隐患。
⑶(6分)合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有 性。
② (填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是 (填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入 (填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是 (填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是 。

| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3~t4阶段为使用催化剂。
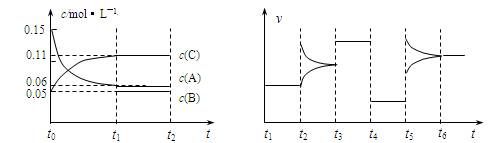
⑴ 若t1 = 15s,则t0~t1阶段以C浓度变化表示的反应速率为v(C) = 。
⑵ 若t2~t3阶段,C的体积分数变小,此阶段v(正) v(逆) (填“>”、“=”、“<”)。
⑶ t4~t5阶段改变的条件为 ,B的起始物质的量为 。
⑷ t5~t6阶段容器内A的物质的量共减小0.03 mol,而此过程中容器与外界的热交换总量为a kJ,写出该反应的热化学方程式:
。
2008.3
一、选择题(每小题4分,共60分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
C
D
C
C
D
B
D
A
D
C
B
C
D
B
A
二、选择题(每小题4分,选对但不全得2分,共28分)
题号
16
17
18
19
20
21
22
答案
AB
D
B
BCD
B
BD
D
23.(1)3 4;6;2(前3空各1分,最后一空2分)
(2)① (1分)
(1分)
②左(2分)
③电源 电压过低 线圈匝数过少 弹簧劲度系数太大(共3分,答对一条得2分,答对2条得3分)
电压过低 线圈匝数过少 弹簧劲度系数太大(共3分,答对一条得2分,答对2条得3分)
24.(16分)
(1)设小球刚刚进入电场时,竖直方向的速度为 ,则
,则 (2分)
(2分)
设小球在电场中做直线运动时,运动方向与水平方向夹角为 ,
,
则 (2分)
(2分)

 (2分)
(2分)
(2)小球平抛运动过程的时间为 ,则
,则
 (2分)
(2分)
进入电场后,在水平方向上,

 (2分)
(2分)
 (1分)
(1分)
(或设B点到极板上端的距离为L,则 在竖直方向上:
在竖直方向上: )
)
(3)小球到达B点时的水平速度 (2分)
(2分)
竖直分速度 (2分)
(2分)
 (1分)
(1分)
或从A到B由动能定理知:

25.(18分)
(1)回路中平均电动势 (2分)
(2分)
回路中总电阻 (2分)
(2分)
电荷量 (2分)
(2分)
(2)设 时刻导体棒AB的速度为V
时刻导体棒AB的速度为V  (1分)
(1分)
此时导体棒AB产生电动势为 (1分)
(1分)
安培力 (1分)
(1分)
由牛顿第二定律 (1分)
(1分)
 (2分)
(2分)
(3)AB棒末速度 (1分)
(1分)
由动能定理 (2分)
(2分)

 (1分)
(1分)

 (2分)
(2分)
26.(17分)
(1)红色、厚果皮(2分) 绿:红=1:1(2分) 厚:薄=3:1(2分)(只写比例无对应性状不得分)
(2)基因和环境共同作用(2分)
(3)(方法正确、结果与结论相对应即可得分)
方法一:用纯种小果实普通甜椒与大果实太空甜椒杂交(3分)。
若子代全部为大果实,则太空甜椒基因型为DD(2分);
若子代全部为小果实,则太空甜椒基因型为 (2分);
(2分);
若子代呈现两种性状,则太空甜椒基因型为 (2分)。
(2分)。
方法二:
①用纯种大果实太空甜椒自交(2分)。若子代出现性状分离,则太空甜椒基因型为 (2分);若子代全部为大果实,则太空甜椒的基因型为DD或
(2分);若子代全部为大果实,则太空甜椒的基因型为DD或 (2分)
(2分)
②用纯种小果实普通甜椒与大果实太空甜椒杂交(1分)。若子代全部为大果实,则太空甜椒基因型为DD(1分);若子代全部为小果实,则太空甜椒基因型为 (1分)。
(1分)。
27.(16分)
(1)叶面积指数在 范围内,随叶面积指数的增加,有机物积累增加(1分);叶面积指数超过
范围内,随叶面积指数的增加,有机物积累增加(1分);叶面积指数超过 ,有机物积累量反而下降(1分)。种植农作物要合理密植(2分)
,有机物积累量反而下降(1分)。种植农作物要合理密植(2分)
(2)增加光照,提高温度,提高光合作用效率(1分);夜间降温,能抑制细胞呼吸,减少有机物的消耗,从而有利于有机物的积累,提高产量(1分)。利用农作物秸秆等进行沼气池发酵,利用发酵产生的余热使温室升温(符合题意即可得2分)
(3)①取两只烧杯,编号为A、B,放人等量淀粉糊,在A烧杯中加入 土壤浸入液,B烧杯中加人
土壤浸入液,B烧杯中加人 蒸馏水(2分)。
蒸馏水(2分)。
②在室温下放置一段时间后,分别取A、B烧杯中的溶液 ,各放人两支试管中,分别编号为
,各放人两支试管中,分别编号为 。(2分)
。(2分)
③在 、
、 中各加入碘液,在
中各加入碘液,在 、
、 中各加入斐林试剂。(2分)
中各加入斐林试剂。(2分)
④采取相应措施观察试管中溶液的颜色变化,记录实验结果。(2分)
28.(13分)
(1)坩埚、坩埚钳、泥三角(3分,填对一个给1分,有错误本空为0分);过滤(2分)
(2)步骤Ⅱ中得到溶液的红色比步骤I中得到溶液的红色深(2分)
(3)+2价(2分)
(4) (2分);沉淀部分溶解(2分)
(2分);沉淀部分溶解(2分)
29.(13分)
(1) (3分)
(3分)
(2)① (2分)
(2分)
②[Na+]>[S2-]>[OH-]>[H+](3分)
(3) ① (2分)
(2分)
②N>0>H或N、O、H(3分)
30.(16分)
(1) (2分,不写单位扣1分)
(2分,不写单位扣1分)
(2)减小压强(2分); (2分,不写单位扣1分);
(2分,不写单位扣1分);
0.84(2分); (2分)
(2分)
(3)

(3分,不写可逆号、热量表示错误各扣1分)
(4) (3分,写对2个3分,对1个给1分)
(3分,写对2个3分,对1个给1分)
【选做部分】
31.(8分)【化学―化学与技术】
(1)稀释 以防爆炸。(1分)
以防爆炸。(1分)
(2) (2分);
(2分);
 (1分)
(1分)
(3)连续测定吸收塔内溶液的 (1分)
(1分)
(4)蒸发、结晶、过滤(3分,答对一个给1分)
32.(8分)【化学一物质结构与性质】
(1) ;
; (各1分,共2分)
(各1分,共2分)
(2)直线型; 低;  为分子晶体,
为分子晶体, 为原子晶体(各1分,共3分)
为原子晶体(各1分,共3分)
(3) ; 2(各1分,共2分)
; 2(各1分,共2分)
(4)B(1分)
33.(8分)【化学―有机化学基础】
(1)  ;
; (各1分,共2分)
(各1分,共2分)
(2)加成反应; 缩聚反应(各1分,共2分)
(3)②
(2分,条件错误扣1分)
④
(2分,条件错误扣1分)
34.(8分)【生物一生物技术实践】
(1)提供碳源、氮源、磷酸盐和维生素
(2)添加高浓度糖 将培养基的 调至酸性 琼脂(凝固剂)
调至酸性 琼脂(凝固剂)
(3)灭菌 保证每次划线时接种环上的酵母菌来自上一划线的末端(1分);通过增加划线次数使酵母菌数目逐渐减少,最后得到由单个细胞繁殖而来的菌落(1分)。
(4)挑选葡萄 冲洗
冲洗 榨汁
榨汁 酒精发酵
酒精发酵 果酒
果酒
35.(8分)【生物―现代生物科技专题】
(1)纤维素酶和果胶酶 无菌 愈伤
(2)免疫处理的B淋巴细胞和骨髓瘤细胞 抗生素、血清、血浆等 既能迅速繁殖,又能产生专一的抗体
(3)克服远缘杂交不亲和的障碍 灭活的病毒
36.(8分)
(1)在冰水混合物中时,被封气体发生等温变化
 (1分)
(1分)

 (1分)
(1分)
又 (1分)
(1分)
 (1分)
(1分)
(2)当被封气体温度变为 时,气体发生等压变化
时,气体发生等压变化

其中

 (2分)
(2分)
37.(8分)
(1)在波的传播方向上,各质点起振方向都相同,与此时刻 处质点振动方向相同,沿
处质点振动方向相同,沿 轴负方向.
(2分)
轴负方向.
(2分)
(2)由波的图像可得波长 ,P点第一次到达波谷时间即为P点前方距P点最近的波谷传播到P所用时间
,P点第一次到达波谷时间即为P点前方距P点最近的波谷传播到P所用时间 (3分)
(3分)
(3)
 P、Q两质点振动情况相反
P、Q两质点振动情况相反
 当P到波峰时,Q质点在波谷. (3分)
当P到波峰时,Q质点在波谷. (3分)
38.(8分)
(1): (3分)
(3分)
(2)衰变时满足动量守恒: (1分)
(1分)
已知:
 (1分)
(1分)
 (1分)
(1分)
又 (1分)
(1分)
 (1分)
(1分)
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
| ||||||||||||||||||||||||||||||||||