
题目列表(包括答案和解析)
(12分)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g) 2SO3(g) △H=―190 kJ·mol—1
⑴该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
⑵判断该反应达到平衡状态的标志是_______________。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d. v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行的是_______________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡_________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
(16分) 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)? ?2SO3(g) ΔH=-190kJ·mol-1
?2SO3(g) ΔH=-190kJ·mol-1
(1)该热化学反应方程式的意义是_______________________________________________
升高温度上述反应平衡常数____(填“变大”“变小”或“不变”)。
(2)下列描述中能说明上述反应已达平衡的是________。
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(3)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol,则v(O2)=__________mol·L-1·min-1;若继续通入0.20 mol SO2和0.10 mol O2,则平衡________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(SO3)<________mol。
在固定容积的密闭容器中进行反应:2SO2(g)+O2(g)  2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2
mol·L-1,0.1 mol·L-1,0.2 mol·L-1,当反应达到平衡时,各物质的浓度(mol·L-1)可以是(设趋向平衡的过程中内外无物质的交换)
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2
mol·L-1,0.1 mol·L-1,0.2 mol·L-1,当反应达到平衡时,各物质的浓度(mol·L-1)可以是(设趋向平衡的过程中内外无物质的交换)
A.SO2为0.4 O2为0.2 B.SO2为0.26
C.SO2和SO3都为0.18 D.SO3为0.4
若氧元素只有16O、18O两种核素,下列说法正确的是
A.16O2与18O2互为同位素
B.向2SO2(g)
+ O2(g)  2SO3(g) 的平衡体系中加入18O2,达到新的平衡后18O2只出现在O2与SO3中
2SO3(g) 的平衡体系中加入18O2,达到新的平衡后18O2只出现在O2与SO3中
C.CH3COOH和CH3CH218OH发生酯化反应时,产物中分子式为H218O
D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子
(12分)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:2SO2(g)+O2(g) 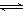 2SO3(g)
△H=―190 kJ·mol—1
2SO3(g)
△H=―190 kJ·mol—1
⑴该反应500℃时的平衡常数________450℃时的平衡常数(填“>”、“<”或“=”)。
⑵判断该反应达到平衡状态的标志是_______________。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d. v(O2)正=2v(SO3)逆
e.容器中混合气体的密度保持不变
⑶欲提高SO2的转化率,下列措施可行的是_______________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
⑷在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3 0.18 mol;若继续通入0.20 mol SO2和0.10 mol O2,则平衡_________________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com