
题目列表(包括答案和解析)
下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:
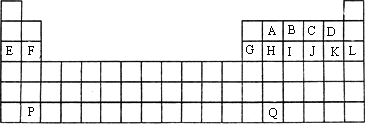
(1)在上表所列出的短周期元素中
①性质最不活泼的是________;②原子半径最大的是(除稀有气体元素)________.
③形成的气态氢化物最稳定的是________;
④最高价氧化物对应的水化物中酸性最强的是________碱性最强的是________.
⑤形成的阴离子还原性最弱的是________,阳离子半径最小的是________.
(2)用电子式表示下列物质的形成过程
①F与D形成的化合物________________;
②A与C形成的化合物________________.
(3)设P的原子序数为Z,则F的原子序数为________,Q的原子序数为________.
地沟油是质量极差、极不卫生,很多毒害成分严重超标的非食用油.为了鉴别地沟油,天津农业科学院张强教授写了《地沟油识别与检测方法研究现状》,根据地沟油在产生和回收过程的变化,做了如下鉴别分析,请同学们解答相应问题.
(1)地沟油的水分、比重、折射率、氧化值均不符合食用油标准.请举出检测地沟油中水分检测方法:________.
(2)在地沟油回收及加工过程中因受到污染,或接触金属器皿后引入重金属,因此,重金属有可能成为地沟油特征化学成分.请根据选修四教材内容写出检验和除去Pb2+的离子方程式:________.
(3)对精炼后地沟油进行检测,发现大量C9~C14烷烃(说明该地沟油已被矿物油污染或不法分子掺兑),并检测到油脂氧化变质二级物质——己醛.请写出己醛与新制氢氧化铜或银氨溶液反应的化学方程式:________.
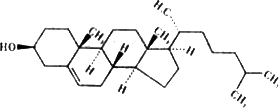
(4)动物油脂普遍含有相对较高胆固醇,而植物油一般不含或含有极少胆固醇,因此可通过检测胆固醇含量判定植物油是否含有动物油.已知胆固醇的结构如图所示,则胆固醇的分子式为:________.
(5)油脂属非导电物质,电导率极低.地沟油中残渣微粒,含有一定量盐,还有酸败产生的化合物也会使电导率提高.请说出影响溶液导电能力的三个因素:________.
(6)针对餐具洗涤剂表面活性剂十二烷基苯磺酸钠混在地沟油里,而食用油不含这种人工合成化学物质,请写出十二烷基苯磺酸钠的结构简式(烷基写成——C10Hn形式),苯环上有两个取代基且在对位:________.地沟油成分复杂,各种检测都有一定的局限性,特别是含量大小直接影响检测的准确性,要真正成为一个规范检测项目,还需要同学们努力学好化学,认真探索,保证我们的饮食健康.
下图是中学教材中元素周期表的一部分,试回答下列问题:
| ① | | | | | ||||||||||||||||||||
| | | | | ② | ③ | ④ | ⑤ | | | |||||||||||||||
| ⑥ | | | | | | | | | | | | ⑦ | ⑧ | | ⑨ | ⑩ | 11 | |||||||
| 12 | | | | | | | | | | | | | 13 | | | | | |||||||
| | | | | | | | | | | | | | 14 | | | 15 | | |||||||
| | | | | | | | | | | | | | | | | | | |||||||
下图是中学教材中元素周期表的一部分,试回答下列问题:
|
① |
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
② |
③ |
④ |
⑤ |
|
|
|||||||||||||||
|
⑥ |
|
|
|
|
|
|
|
|
|
|
|
⑦ |
⑧ |
|
⑨ |
⑩ |
11 |
|||||||
|
12 |
|
|
|
|
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14 |
|
|
15 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
(1)在上表所列出的短周期元素中(填具体物质化学式)
①性质 最不活泼的是 ;
②原子半径最小的是(除稀有气体元素) _ 。简单阴离子半径最大的是 。
③形成的气态氢化物最稳定的是 ;
④最高价氧化物对应的水化物酸性最强的是 ,
⑤在⑤⑩15三种元素形成的阴离子中还原性最强的是 ,
⑥可作半导体的是 (填表中编号)
(2)用电子式表示②与④形成的化合物的形成过程 __。
(3)⑨与12形成的化合物溶于水所克服的微粒间作用力为 。
(4)13在元素周期表中的位置是 ,元素③形成的单质的结构式为 。
(5)________(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式是___________________________________________。
(6) “神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___ _(填表中编号)元素组成的,用化学方程式表示吸收原理:_________________ ______ 。
(7)设②的原子序数为Z,则14的原子序数为 (用Z表示)。
考查知识点:根据元素周期表,①比较金属性,非金属性,对应粒子还原性及半径的大小;②判断元素在周期表的位置;③化学键 ④位置确定序数;⑤位置推测用途
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com