(1)某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液.其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗敖在铁架台的铁圈中:
B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞:
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞:
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔:
H.静置、分层.就此实验,完成下列填空:
正确操作步骤的顺序是:
CBDAHGEF
CBDAHGEF
.
(2)向MnSO
4和硫酸的混合溶液里加入K
2S
2O
8(过二硫酸钾),溶液会发如下反应:Mn
2++S
2O
82-+H
2O→MnO
4-+H
+.该反应常用于检验Mn
2+的存在.其特征现象是
溶液由无色变为紫色
溶液由无色变为紫色
.若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有
氯气
氯气
.
(3)将NaBiO
3固体(黄色微溶)加入到MnSO
4和H
2SO
4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
10
10
NaBiO
3+
4
4
MnSO
4+
14
14
H
2SO
4-
3
3
Na
2SO
4+
5
5
Bi
2(SO
4)
3+
4
4
NaMnO
4+
14
14
H
2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
Bi2(SO4)3
Bi2(SO4)3
.



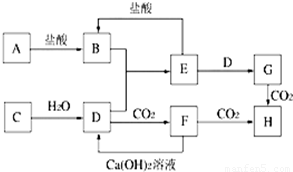
 图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为短周期金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)
图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为短周期金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)