
题目列表(包括答案和解析)
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。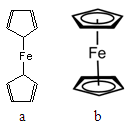
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式 。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。(1) 铝热反应在工业生产中的重要用途之一是 ;用化学方程式表示出其中的原理 (举一例)。铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若将氧化铝与氢氧化钠溶液作用,反应的化学方程式为 。
(2)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是 (写化学式)。缺铁性贫血患者应补充Fe元素,通常以硫酸亚铁的形式给药,而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是
。(用化学方程式表示)。
(4)氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3 C = 2AlN + 3CO
①在化学方程式上标出该反应中电子转移的方向和数目。
②在该反应中,氧化剂是 ,氧化产物是 。


元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
① CO可以和很多过渡金属形成配合物。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO中中心原子的杂化类型为 杂化,与CO互为等电子体的分子和离子有(各写一种): 、 。
② Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
③ Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 ,得到新的配合物有 种
④ 配合物 分子内的作用力有 (填编号)。
分子内的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
 ⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
(3)铜是是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。
⑥ CuH的晶体结构如图所示,该晶体中Cu+的配位数为 。CuH具有许多特殊性质,如易分解、能与水反应、在氯气中燃烧等。写出CuH在氯气中燃烧的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com